Calciumhydrid (CaH2) Egenskaber, Reaktivitet og anvendelser
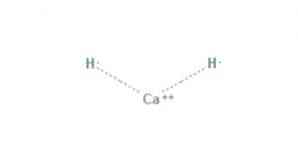
den calciumhydrid er en kemisk forbindelse med formlen CaH2, hvilket gør det til et jordalkalimidrid. Denne kemiske forbindelse har to ioniske bindinger mellem calcium og de to hydridioner, som vist i figur 1.
Det er en saltvand hydrid, hvilket betyder, at dens struktur svarer til salt. Den krystallinske struktur er den samme som for blychlorid (Cotunnite mineral) som vist i figur 2.

Alle alkaliske og jordalkalimetaller danner hydridsalte. I kemi er et hydrid hydrogenanion, H- eller mere almindeligt en forbindelse, hvori et eller flere hydrogencentre har nukleofile, reducerende eller basale egenskaber.
I forbindelser, der betragtes som hydrider, er hydrogenatomet bundet til et mere elektropositive element eller gruppe.
Det kan fremstilles ved at reagere calcium og hydrogen ved en temperatur mellem 300 og 400 grader Celsius. En anden måde at forberede calciumhydrid på er at opvarme calciumchloridet sammen med hydrogen og natriummetal. Reaktionen sker som følger:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
I denne reaktion calcium (Ca) og hydrogen (H) skaber et molekyle calciumhydrid mens natrium atomer med klor molekyler skabe natriumchlorid (NaCl).
Calciumhydrid kan også fremstilles ved at reducere calciumoxid (CaO) med magnesium (Mg). Reaktionen udføres i nærvær af hydrogen. Denne reaktion producerer også magnesiumoxid (MgO). Nedenfor er formlen for denne kemiske reaktion:
CaO + Mg + H2 → CaH2 + MgO
indeks
- 1 Fysiske og kemiske egenskaber af calciumhydrid
- 2 Reaktivitet og farer
- 3 Håndtering og opbevaring
- 4 anvendelser og applikationer
- 4.1 tørremiddel
- 4.2 Hydrogenproduktion
- 4.3 Reduktionsmiddel
- 5 Ulempe ved brugen af calciumhydrid
- 6 referencer
Fysiske og kemiske egenskaber af calciumhydrid
Calciumhydrid er et sæt krystaller med en hvid orthorhombisk struktur, når den er ren. Generelt er det sjældent at finde det i denne form, så det har normalt en gråagtig nuance. Det mangler en karakteristisk lugt. Dets udseende er vist i figur 3 (Royal Society of Chemistry, 2015).

Det har en molekylvægt på 42.094 g / mol, der har et smeltepunkt på 816 grader Celsius og en densitet på 1,70 g / ml. Hvis det opløses i vand reagerer det voldsomt producerende brint. Det reagerer også med alkohol (National Center for Biotechnology Information., S.F.).
Reaktivitet og farer
Calciumhydrid er et stabilt kemikalie, selvom det er yderst reaktivt over for vand eller fugt. Ved kontakt med vand frigør det brandfarlige brintgasser, der kan antændes spontant.
Det betragtes som en eksplosiv forbindelse. Når det opvarmes i en reaktion med tetrahydrofuran, kan det forårsage en eksplosion. Når det blandes med chlorat, hypochlorit, bromat, kaliumperchlorat, bliver det følsomt for varme, friktion og bliver eksplosiv (Calciumhydride 7789-78-8, 2016).
Når sølvfluoridet knuses med calciumhydrid, bliver massen glødende. Sterk opvarmning af hydridet med chlor, brom eller iod fører til glødning.
Hydrid blandinger med forskellige bromater, f.eks barium bromat eller chlorat, såsom barium chlorat og perchlorater såsom kalium perchlorat, udnytte formalingen. CaH2 reagerer glødeløst med sølvfluorid, hvis det er fri for friktion.
Denne forbindelse skal håndteres under en inert atmosfære. Hvis det ikke håndteres korrekt, kan det udgøre en alvorlig trussel mod sundheden og sikkerheden for laboratoriepersonale, livreddere og kemikalieaffald handlere (UC Center for Laboratory Sikkerhed, 2013).
Yderst farlig i tilfælde af kontakt med hud eller øjne, da det er irriterende. Meget farlig i tilfælde af kontakt med huden, fordi det kan være ætsende.
Det er også farligt ved indtagelse og indånding. Mængden af vævsskade afhænger af kontaktens længde. Kontakt med øjnene kan resultere i hornhindebeskadigelse eller blindhed.
Kontakt med huden kan forårsage betændelse og blærer. Indånding af støv vil forårsage irritation i mave-tarmkanalen eller luftvejene, der er kendetegnet ved brænding, nysen og hoste.
Alvorlig overeksponering kan forårsage lungeskader, kvælning, bevidstløshed og endda død. Øjenbetændelsen er karakteriseret ved rødme, irritation og kløe. Betændelse i huden er præget af kløe, skrælning, rødme eller lejlighedsvis blærer.
Gentagen udsættelse for øjnene til et lavt niveau kan forårsage øjenirritation. Gentagen udsættelse for huden kan forårsage lokal hudødelæggelse eller dermatitis.
Gentagen indånding af støv kan forårsage en varierende grad af åndedrætsirritation eller lungeskader. Gentagen eller længerevarende indånding af støv kan forårsage kronisk åndedrætsirritation (Material Safety Data Sheet Calcium Hydride MSDS, 2005).
Hvis øjenkontakt, bør straks fjernes med vand i mindst 15 minutter, og løft de øvre og nedre øjenlåg.
Ved hudkontakt skal skylles straks med rigeligt vand i mindst 15 minutter, mens der fjernes forurenet tøj og sko.
Ved indtagelse skal opkast ikke fremkaldes. Et giftkontrolcenter skal kaldes. Det er tilrådeligt at forlade udstillingsstedet og straks flytte til naturen.
Ved indånding, hvis vejret er svært, er det nødvendigt at give ilt. Mund-til-mund vejrtrækning bør ikke gives, hvis offeret indtages eller indåndes stoffet.
Kunstig åndedræt bør induceres ved hjælp af en lommemaske udstyret med en ensrettet ventil eller anden egnet respiratorisk medicinsk anordning. I alle tilfælde skal lægehjælp indhentes straks.
Håndtering og opbevaring
Forbindelsen bør opbevares i en tør beholder væk fra varme. Det bør holdes væk fra antændelseskilder. Undgå indånding af støv. Der må ikke tilsættes vand til dette produkt
Ved utilstrækkelig ventilation skal der anvendes egnet åndedrætsværn, f.eks. En filtermaske. Ved eksponering skal du søge lægehjælp og vise etiketten så meget som muligt. Undgå kontakt med hud og øjne.
Brandfarlige materialer skal generelt opbevares i et separat sikkerhedsskab eller opbevaringsrum. Hold beholderen tæt lukket.
Opbevares på et køligt og godt ventileret sted. Alt udstyr, der indeholder materiale for at undgå elektriske gnister, skal jordes. Beholderen skal opbevares tør og på et køligt sted.
Det er et ikke brændbart materiale. Brandmænd skal imidlertid bære passende udstyr, mens slukke en brand omkring denne kemiske forbindelse.
Det er aldrig tilrådeligt at bruge vand til at slukke en brand omkring calciumhydrid. Tørt sand kan anvendes såvel som forbindelser som natriumchlorid og natriumcarbonat til dette formål.
For at fjerne rester calciumhydrid, skal sønderdeles ved tilsætning af 25 ml methanol per gram hydrid under nitrogenatmosfære under omrøring.
Efter endt reaktionen samme mængde vand tilsættes til opslæmningen af calcium methoxid og kasseret ned i afløbet med vand (National Research Council, 1995).
Anvendelser og applikationer
Tørremiddel
Kaliumhydrid er et relativt mildt tørremiddel. Grund af denne grund, at anvendelsen af denne forbindelse som et tørremiddel er sikrere sammenlignet med flere reaktive midler, såsom natrium-kalium legeringer og metallisk natrium. Reagerer med vand på følgende måde:
CaH2 + 2 H20 → Ca (OH) 2 + 2 H2
Hydrolyseprodukterne fra denne reaktion, hydrogen (gas) og Ca (OH) 2 (en vandig blanding) kan adskilles fra det kemiske opløsningsmiddel efter en filtrerings-, destillations- eller dekanteringsproces.
Denne kemiske forbindelse er et effektivt tørremiddel til mange basiske opløsningsmidler, såsom aminer og pyridin. Nogle gange er det vant til at fortørre opløsningsmidler, før der anvendes mere reaktive tørremidler.
Hydrogenproduktion
I 1940'erne var denne forbindelse tilgængelig som en kilde til hydrogen under handelsnavnet "Hydrolith".
Det har i lang tid været brugt som kilde til hydrogen. Stadig det anvendes til fremstilling af rent hydrogen i laboratorier til forskellige forsøg, avancerede brændselsceller og batterianvendelser (American Elements, S.F.).
Forbindelsen har været meget udbredt i årtier som et sikkert og bekvemt middel til opblæsning af vejrballoner.
Ligeledes anvendes det regelmæssigt i laboratorier til fremstilling af små mængder af meget rent hydrogen til forsøg. Fugtindholdet i dieselbrændstof beregnes af hydrogen udviklet efter behandling med CaH2.
Reduktionsmiddel
Ved opvarmning mellem 600 og 1000 grader Celsius kan zirconiumoxid, niob, uran, krom, titanium, vanadium og tantal reduceres til fremstilling af pulveret af disse metaller, således at calciumhydrid kan anvendes i metallurgi af støv.
Den følgende reaktion illustrerer den måde, hvorpå calciumhydrid virker som et reduktionsmiddel:
TiO + 2CaH2 → CaO + H2 + Ti
Ulempe ved brugen af calciumhydrid
Denne kemiske forbindelse er ofte det foretrukne valg som et tørremiddel; Det har dog også nogle ulemper:
-Tørringsvirkningen af denne forbindelse er langsom, da den ikke er opløselig i et hvilket som helst opløsningsmiddel, med hvilket det ikke reagerer voldsomt.
-Denne pulverforbindelse er uforenelig med mange opløsningsmidler. Din reaktion med chlorcarboner kan endda forårsage eksplosioner.
-Det kan ikke anvendes til deoxygenerende opløsningsmidler, da det ikke er i stand til at fjerne opløst oxygen.
-Differentiering mellem calciumhydrid og calciumhydroxid er ret vanskelig på grund af dens lignende fremtoninger.
referencer
- Amerikanske elementer. (S.F.). calciumhydrid. Hentet fra americanelements.com: americanelements.com.
- Calciumhydrid 7789-78-8. (2016). Hentet fra chemicalbook.com: chemicalbook.com.
- calciumhydrid. (N.D.). Hentet fra kemi elev: chemistrylearner.com.
- Sikkerhedsdatablad Kalsiumhydrid MSDS. (2005, oktober 10). Hentet fra sciencelab.com: sciencelab.com.
- National Center for Bioteknologi Information. (S.F.). PubChem Compound Database; CID = 105052. Hentet fra pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- nationale forskningsråd. (1995). Forsigtig praksis i laboratoriet: Håndtering og bortskaffelse af kemikalier. Washinton: NationalAcademy Press.
- Royal Society of Chemistry. (2015). calciumhydrid ID 94784. Hentet fra chemspider.com: chemspider.com.
- UC center for laboratoriesikkerhed. (2013, januar 18). standard driftsprocedure calciumhydrid. Hentet fra chemengr.ucsb.edu: chemengr.ucsb.edu.


