Endoterme reaktionsegenskaber, ligninger og eksempler
en endoterm reaktion er det, der skal ske for at absorbere energi, i form af varme eller stråling, fra omgivelserne. Generelt kan de, selvom de ikke altid, genkendes af en temperaturfald i deres omgivelser; eller tværtimod har de brug for en kilde til varme, sådan som opnås ved en brændende flamme.
Absorptionen af energi eller varme er, hvad alle endoterme reaktioner har til fælles; Arten af det samme, samt de involverede transformationer, er meget forskellige. Hvor meget varme skal de absorbere? Svaret afhænger af dets termodynamik: den temperatur, hvor reaktionen sker spontant.

For eksempel er en af de mest emblematiske endoterme reaktioner tilstandsændringen fra is til flydende vand. Isen skal absorbere varme, indtil temperaturen når ca. 0ºC; ved denne temperatur bliver dens smeltning spontan, og isen vil absorbere, indtil den er helt smeltet.
I varme rum, f.eks. På strandstranden, er temperaturen højere, og derfor absorberer isen varme hurtigere. det smelter i højere hastighed. Smeltning af gletsjere er et eksempel på en uønsket endoterm reaktion.
Hvorfor sker det sådan? Hvorfor kan is ikke præsenteres som et varmt faststof? Svaret ligger i den gennemsnitlige kinetiske energi i vandmolekylerne i begge stater, og hvordan de interagerer med hinanden gennem deres hydrogenbindinger.
I flydende vand har molekylerne større bevægelsesfrihed end i is, hvor de vibrerer stationært i deres krystaller. For at bevæge sig skal molekylerne absorbere energi på en sådan måde, at deres vibrationer bryder de stærke retningsbestemt hydrogenbroer i isen.
Af denne grund absorberer isen varme til at smelte. For at der skal være en "hot ice", skal brintbroerne være unormalt stærke til at smelte ved en temperatur, der ligger godt over 0 ° C.
indeks
- 1 Karakteristik af en endoterm reaktion
- 1,1 ΔH> 0
- 1.2 Cool deres omgivelser
- 2 ligninger
- 3 Eksempler på almindelige endoterme reaktioner
- 3.1 Inddampning af tøris
- 3.2 Bagning af brød eller madlavning
- 3.3 Solbadning
- 3.4 Reaktion af atmosfærisk nitrogen og ozondannelse
- 3.5 Vandelektrolyse
- 3.6 Fotosyntese
- 3.7 Løsninger af nogle salte
- 3.8 Termiske nedbrydning
- 3.9 Ammoniumchlorid i vand
- 3.10 Natriumtriosulfat
- 3.11 Bilmotorer
- 3,12 kogende væsker
- 3.13 Tilberedning af æg
- 3.14 Madlavning
- 3.15 Opvarmning af mad i mikrobølgeovnen
- 3.16 Glasstøbning
- 3.17 Forbrug af et stearinlys
- 3.18 Rengøring med varmt vand
- 3.19 Varme sterilisering af mad og andre genstande
- 3.20 Bekæmpelse af infektioner med feber
- 3.21 Vanddampning
- 4 referencer
Karakteristik af en endoterm reaktion
Statens forandring er ikke korrekt en kemisk reaktion; Det samme sker dog: produktet (flydende vand) har mere energi end reaktanten (isen). Dette er hovedkarakteristika for en reaktions- eller endotermisk proces: produkterne er mere energiske end reaktanterne.
Selv om dette er sandt, betyder det ikke, at produkterne nødvendigvis skal være ustabile. I det tilfælde, at det er, ophører den endoterme reaktion at være spontan under alle betingelser for temperatur eller tryk.
Overvej følgende kemiske ligning:
A + Q => B
Hvor Q repræsenterer varme, normalt udtrykt med enhederne af joule (J) eller kalorier (cal). Eftersom A absorberer varme Q for at omdanne til B, er det da sagt, at det er en endoterm reaktion. Således har B mere energi end A, og skal absorbere nok energi til at opnå dens transformation.
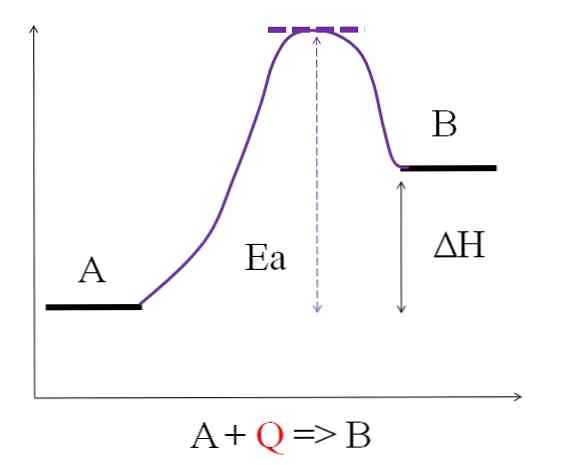
Som det ses i diagrammet ovenfor, har A mindre energi end B. Mængden af varme Q, der absorberer A, er sådan, at den overvinder aktiveringsenergien (den energi, der er nødvendig for at nå den lilla top med prikket tag). Energiforskellen mellem A og B er det, der er kendt som reaktionens entalpy, ΔH.
ΔH> 0
Alle de endoterme reaktioner har til fælles det foregående diagram, da produkterne er mere energiske end reaktanterne. Derfor er energiforskellen mellem dem, ΔH, altid positiv (Hprodukt-Hreagens > 0). Når dette er sandt, skal der være en absorption af varme eller energi fra omgivelserne for at levere dette energiske behov.
Og hvordan fortolkes sådanne udtryk? I en kemisk reaktion forbinder man altid links for at skabe andre. For at bryde dem er energibesparelsen nødvendig; det vil sige, det er en endoterm passage. I mellemtiden indebærer dannelsen af forbindelserne stabilitet, så det er et eksotermt trin.
Når de dannede bindinger ikke tilvejebringer en stabilitet, der er sammenlignelig med mængden af energi, der kræves for at bryde de gamle bindinger, er dette en endoterm reaktion. Derfor er der brug for ekstra energi for at fremme bruddet af de mest stabile bindinger i reagenserne.
På den anden side forekommer det modsatte i de eksoterme reaktioner: varme frigives, og ΔH er < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
De køler deres omgivelser
Selvom det ikke gælder for alle endoterme reaktioner, forårsager flere af dem en nedgang i omgivelsernees temperatur. Dette skyldes, at den absorberede varme kommer fra et sted. Hvis konverteringen af A og B blev bragt i en beholder, ville det derfor afkøle.
Jo mere endoterme reaktionen er, jo koldere beholderen og dens omgivelser bliver. Faktisk er nogle reaktioner endda i stand til at danne et tyndt isdæksel, som om de var kommet ud af et køleskab.
Der er imidlertid reaktioner af denne type, der ikke afkøler deres omgivelser. Hvorfor? Fordi omgivelsens varme er utilstrækkelig; det giver ikke den nødvendige Q (J, cal), der er skrevet i de kemiske ligninger. Derfor er det her, når ilden eller ultraviolet stråling kommer ind.
Der kan opstå en lille forvirring mellem begge scenarier. På den ene side er omgivelsens varme tilstrækkelig til, at reaktionen fortsætter spontant, og der ses en afkøling; og på den anden side er der brug for mere varme, og der anvendes en effektiv opvarmningsmetode. I begge tilfælde sker det samme: energi absorberes.
ligninger
Hvad er de relevante ligninger i en endoterm reaktion? Som allerede forklaret, skal ΔH være positiv. For at beregne det anses følgende kemiske ligning først:
aA + bB => cC + dD
Hvor A og B er reaktantstoffer, og C og D er produkterne. De små bogstaver (a, b, c og d) er de støkiometriske koefficienter. For at beregne ΔH for denne generiske reaktion anvendes følgende matematiske udtryk:
.DELTA.Hproducere- .DELTA.Hreagenser = ΔHrxn
Du kan fortsætte direkte, eller foretage beregningerne separat. For ΔHproducere følgende sum skal beregnes:
c ΔHFC + dΔHFD
Hvor ΔHF det er entalpien af dannelse af hvert stof involveret i reaktionen. Ved konventionen har stofferne i deres mest stabile former ΔHF= 0 For eksempel O molekyler2 og H2, eller et fast metal, de har ΔHF= 0.
Den samme beregning er nu udført for reaktanterne, ΔHreagenser:
til ΔHFA + b ΔHFB
Men som ligningen siger, at ΔHreagenser skal trækkes fra ΔHproducere, så skal den tidligere sum multipliceres med -1. Så du har:
c ΔHFC + dΔHFD - (til ΔHFA + b ΔHFB)
Hvis resultatet af denne beregning er et positivt tal, er det en endoterm reaktion. Og hvis det er negativt, er det en eksoterm reaktion.
Eksempler på almindelige endoterme reaktioner
Fordampning af tøris

Den, der har set de hvide dampe, der kommer fra en iskar, har oplevet et af de mest almindelige eksempler på en endoterm "reaktion".
Ud over et par iser er disse dampe løsnet fra fast hvid, kaldet tøris, også blevet en del af scenarierne for at skabe effekten af dråbe. Denne tøris er intet mere end fast kuldioxid, som absorberer temperatur og før eksternt tryk begynder at sublimere.
Et eksperiment for en børnepublikum ville være at fylde og forsegle en taske med tøris. Efter et stykke tid vil det ende oppe på grund af CO2 gasformigt, som genererer arbejde eller presser indersiden af posen mod atmosfærisk tryk.
Bagning brød eller madlavning

Bagning af brød er et eksempel på en kemisk reaktion, da der nu er kemiske forandringer på grund af varme. Den, der lugter duften af friskbagte brød, ved, at en endoterm reaktion forekommer.
Dejen og alle dens ingredienser har brug for ovnenes varme til at udføre alle de transformationer, der er uundværlige for at blive brødet og udvise sine typiske egenskaber.
Ud over brødene er køkkenet fuld af eksempler på endoterme reaktioner. Hvem cooks beskæftige sig med dem dagligt. Madlavning pasta, blødgør korn, opvarm majskorn, bageæg, krydderier kød, bage en kage, lave te, opvarmning smørbrød; hver af disse aktiviteter er endoterme reaktioner.
solbadning

Så simpelt og almindeligt som de kan synes, falder de solbadninger, som visse krybdyr tager, såsom skildpadder og krokodiller, ind i kategorien af endoterme reaktioner. Skildpadder absorberer varme fra solen for at regulere temperaturen af deres organisme.
Uden solen holder de vandets varme op for at holde varmen; hvad ender med at køle vandet i dine tanke eller fisketanke.
Reaktion af atmosfærisk nitrogen og ozondannelse

Luften består hovedsagelig af nitrogen og ilt. Under tordenvejr frigives der en energi, der kan bryde de stærke bindinger, der holder nitrogenatomer sammen i N-molekylet.2:
N2 + O2 + Q => 2NO
På den anden side kan ilt absorbere ultraviolet stråling for at blive ozon; allotrope af ilt, der er meget gavnligt i stratosfæren, men skadeligt for livet på jorden. Reaktionen er:
3O2 + v => 2O3
Hvor v betyder ultraviolet stråling. Mekanismen bag den simple ligning er meget kompleks.
Vandelektrolyse
Elektrolyse gør brug af elektrisk energi til at adskille et molekyle i dets elementer eller danne molekyler. For eksempel produceres der i elektrolyse af vand to gasser: hydrogen og oxygen, hver i forskellige elektroder:
2H2O => 2H2 + O2
Også natriumchlorid kan lide den samme reaktion:
2NaCl => 2Na + Cl2
I en elektrode vil du se dannelsen af metallisk natrium, og i den anden, grønne bobler af klor.
fotosyntese

Planter og træer skal absorbere sollys som energiforsyning for at syntetisere deres biomaterialer. Til dette bruger CO som råmateriale2 og vand, der gennem en lang række trin omdannes til glucose og andre sukkerarter. Derudover dannes ilt, som frigives fra bladene.
Løsninger af nogle salte
Hvis natriumchlorid er opløst i vand, vil der ikke mærkes nogen mærkbar ændring i beholderens eller beholderens ydre temperatur..
Nogle salte, såsom calciumchlorid, CaCl2, øge temperaturen af vandet som et produkt af Caionens store hydrering2+. Og andre salte, såsom nitrat eller ammoniumchlorid, NH4NO3 og NH4Cl, sænk temperaturen på vandet og afkøle omgivelserne.
I klasseværelserne er der normalt gjort hjemmelavede forsøg ved at opløse nogle af disse salte for at demonstrere, hvad der er en endoterm reaktion.
Faldet i temperatur skyldes hydrering af NH-ionerne4+ det er ikke begunstiget mod opløsningen af de krystallinske arrangementer af dets salte. Som følge heraf absorberer saltene varme fra vandet for at tillade ionerne at blive solvatiseret.
En anden kemisk reaktion, der normalt er meget almindelig at demonstrere dette er følgende:
Ba (OH)2· 8H2O + 2NH4NO3 => Ba (nr3)2 + 2NH3 +10H2O
Bemærk mængden af dannet vand. Ved blanding af begge faste stoffer opnås en vandig Ba-opløsning (NO3)2, med en lugt af ammoniak, og med et sådant temperaturfald, der bogstaveligt talt fryser beholderens ydre overflade.
Termiske nedbrydelser
En af de mest almindelige termiske nedbrydning er natriumbicarbonat, NaHCO3, at producere CO2 og vand, når det opvarmes. Mange faste stoffer, herunder carbonater, har tendens til at nedbrydes for at frigive CO2 og det tilsvarende oxid. For eksempel er dekomponeringen af calciumcarbonat som følger:
CaCO3 + Q => CaO + CO2
Det samme sker med magnesium-, strontium- og bariumcarbonater.
Det er vigtigt at bemærke, at en termisk nedbrydning er forskellig fra en forbrænding. I den første er der ingen tilstedeværelse af tænding eller varme frigives, mens i det andet ja; det vil sige, at forbrænding er en eksoterm reaktion, selvom det er nødvendigt, at en første varmekilde finder sted eller forekommer spontant.
Ammoniumchlorid i vand
Når en lille mængde ammoniumchlorid (NH4Cl) opløses i vand i et reagensglas, bliver røret koldere end tidligere. Under denne kemiske reaktion absorberes varmen fra omgivelserne.
Natriumtriosulfat
Når natriumthiosulfatkrystallerne (Na2S2O3.5H2O), der almindeligvis kaldes hypo, opløses i vand, opstår der en køleeffekt.
Bilmotorer
Brændende benzin eller diesel motorer i biler, lastbiler, traktorer og busser producerer mekanisk energi, som anvendes i den udveksling af sådanne køretøjer.
Kogende væsker
Ved at sætte en væske i varmen får den energi og går i en gasformig tilstand.
Tilberedning af et æg
Når varme påføres, denatureres ægproteinerne og danner den faste struktur, som normalt indtages.
Madlavning mad
Generelt, når der tilberedes varme med henblik på at ændre fødevarens egenskaber, forekommer endoterme reaktioner.
Disse reaktioner er, hvad der får fødevaren til at blive blødere, generere formbare masser, frigive de komponenter, de indeholder blandt andet.
Opvarmning af mad i mikrobølgeovnen
Ved mikrobølgestråling begynder vandmolekyler i fødevarer at absorbere energi, begynder at vibrere og øge temperaturen på mad.
Støbt glas
Opvarmningen af varme ved glasset gør deres ledd mere fleksible, hvilket gør formen lettere at ændre.
Forbrug af et stearinlys
Lysvandet smelter som det absorberer flammerens varme og ændrer sin form.
Rengøring med varmt vand
Når der anvendes varmt vand til at rense objekter, der er farvet med fedt, ligesom gryder og tøj, fedt bliver mere flydende og lettere at fjerne vand.
Varme sterilisering af mad og andre genstande
Ved opvarmning af genstande eller mad øger de mikroorganismer, de indeholder, også deres temperatur.
Når der leveres meget varme, forekommer der reaktioner inden for de mikrobielle celler. Mange af disse reaktioner, som at bryde bindinger eller protein denaturering, ender med at dræbe mikroorganismer.
Bekæmpelse af infektioner med feber
Når feber manifesterer sig, er det fordi kroppen producerer den nødvendige varme til at dræbe bakterier og vira, som forårsager infektioner og genererer sygdomme.
Hvis den dannede varme er høj, og feberen er høj, påvirkes kroppens celler også, og der er risiko for død.
Vanddampning
Når vandet fordampes og omdannes til damp, skyldes det den varme, den modtager fra miljøet. Da den termiske energi modtages af hvert vandmolekyle, stiger dets vibrationsenergi til det punkt, hvor det kan bevæge sig frit, hvilket skaber damp.
referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Learning.
- Wikipedia. (2018). Endoterm proces. Hentet fra: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (27. december 2018). Endoterme reaktionseksempler. Hentet fra: thoughtco.com
- Khan Academy. (2019). Endotermisk vs. eksoterme reaktioner Hentet fra: khanacademy.org
- Serm Murmson. (2019). Hvad sker der på det molekylære niveau under en endoterm reaktion? Hearst Seattle Media. Hentet fra: education.seattlepi.com
- QuimiTube. (2013). Beregning af reaktionsenthalpien fra dannelsen af entalpier. Hentet fra: quimitube.com
- Quimicas.net (2018). Eksempler på endoterm reaktion. Hentet fra:
quimicas.net.


