Forsæbningsreaktion og stoffer, der kan opnås
den forsæbning Det er den grundlæggende hydrolyse af en ester. Dette betyder, at esteren reagerer med en base (NaOH eller KOH) irreversibelt, hvilket producerer alkohol og carboxylater af natrium eller kalium. Ordet betyder "fremstilling af sæber" og er faktisk en af de ældste kemiske reaktioner, der anvendes af menneskeheden.
I de babyloniske tider blev de med hjælp fra asken opsamlet fra træ og planter og animalske fedtstoffer perfektioneret til at gøre sæber. Hvorfor dyrefedt? Årsagen er, at den er rig på glyceroltriestere (triglycerider), og træaske er en kilde til kalium, det grundlæggende metal.
Ellers fortsætter reaktionen til et lavere udbytte, men nok til at reflektere dets virkninger på malingerne og nogle overflader. Det er tilfældet med oliemalerier, hvor pigmenterne blandes med olie (esterkilde).
indeks
- 1 forsæbningsreaktion
- 1.1 mekanisme
- 1.2 Kinetik
- 2 Stoffer, der kan opnås ved forsæbning
- 2.1 Opløsning af sæber
- 3 referencer
Forsæbningsreaktion
mekanisme
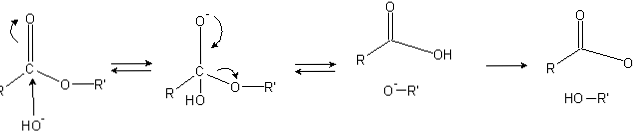
Estrene har en acylgruppe (O = C-R), som er modtagelig for nukleofile angreb såsom OH-.
Fordi iltatomer "stjæler" elektronisk tæthed fra carbonatomet, er det delvist ladet, endnu mere så i tilfælde af estere.
Følgelig tiltrækker denne positive ladning negative arter, der er i stand til at forsyne elektroner med carbonatomet, idet det nukleofile angreb forekommer (venstre side af billedet). Som følge heraf dannes et tetrahedralt mellemprodukt (det andet molekyle fra venstre til højre).
Den negative ladning på oxygenet af det tetrahedrale mellemprodukt er produktet af en OH- omgivende. Derefter delvistes denne negative ladning for at stamme fra carbonylgruppen og "tvinge" til at bryde C-OR'-bindingen. Også denne flytning producerer en carboxylsyre RCOOH og en alkoxidion R'O-.
Endelig, som reaktionsmediet er basisk, deprotonerer alkoxidet et molekyle vand, og carboxylsyren reagerer med en anden OH- af mediet, der genererer forsæbningsprodukterne.
kinetik
Forsprøjtningsreaktionens hastighed er proportional med koncentrationerne af reaktanterne. Med andre ord, at forøge enten koncentrationen af esteren (RCOOR ') eller basen (NaOH), vil reaktionen fortsætte med en højere hastighed.
Dette er også oversat som følger: forsæbningshastigheden er første orden med hensyn til esteren og første orden med hensyn til basen. Ovennævnte kan udtrykkes med følgende matematiske ligning:
Hastighed = k [RCOOR '] [NaOH]
Hvor k er konstant eller hastighedskoefficienten, som varierer som en funktion af temperatur eller tryk; det vil sige jo højere varmen desto større forsæbningshastigheden. Af denne grund er mediet underkastet kogning.
Da begge reagenser er af første række kinetiske, er den samlede reaktion anden rækkefølge.
I reaktionsmekanismen for forsæbning kræver dannelsen af det tetrahedrale mellemprodukt det nukleofile angreb, hvilket involverer både esteren og basen.
Således reflekteres andenordens kinetik i denne kendsgerning, fordi de intervenerer i reaktionens (langsomt) determinant-trin.
Stoffer, der kan opnås ved forsæbning

De vigtigste produkter af forsæbningen er alkoholer og salte af carboxylsyrer. I et surt medium opnås de respektive RCOOH, der opnås ved forsæbning af fedtstoffer og olier, der er kendt som fedtsyrer..
På denne måde består sæbe af salte af fedtsyrerne som følge af forsæbning. Går du ud med hvilke kationer? De kan være Na+, K+, mg2+, tro3+, etc.
Disse salte er opløselige i vand, men præcipiteres ved virkningen af NaCl tilsat til blandingen, som dehydrerer sæbe og adskiller den fra den vandige fase. Forsæbningsreaktionen for et triglycerid er som følger:
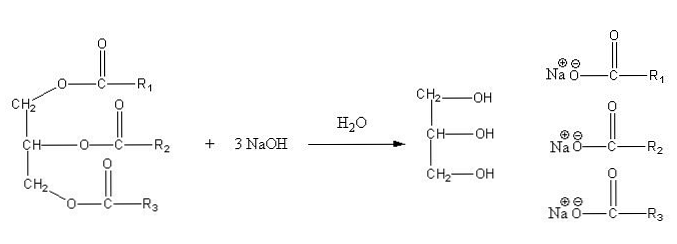
Glycerin er den alkoholiske "E", og sæbe er alle salte af de resulterende fedtsyrer. Her har hver sidekæde -R forskellige længder og grad af umættethed. Følgelig gør disse kæder forskellen mellem fedtstoffer og vegetabilske olier.
Nøglen til fremstilling af sæber ligger i udvælgelsen af de bedste fedtstoffer og olier, eller mere specifikt ved udvælgelsen af forskellige kilder til triglycerider.
Denne hvide sæbevand kan indeholde farvestoffer og andre organiske forbindelser i sin struktur, hvilket giver det behagelige aromaer og lyse farver. Herfra er muligheden for muligheder tæmmet af kunst og kald i denne handel.
Forsæbningsreaktionen er imidlertid også en syntetisk vej af carboxylsyrer og alkoholer, der ikke nødvendigvis har at gøre med glycerin eller sæbe.
For eksempel vil basisk hydrolyse af en hvilken som helst ester, såsom simpel ethylacetat, producere eddikesyre og ethanol.
Opløsningsmiddelvirkning af sæber

Saltene af fedtsyrerne er opløselige i vand, men ikke på samme måde som ionerne er solvatiserede; det er omgivet af en vandig kugle. I tilfælde af sæber, forhindrer deres sidekæder -R deres teorier i at opløses i vand.
For at modvirke denne energisk ubehagelige position er de derfor orienteret på en sådan måde, at disse kæder kommer i kontakt og danner en apolær organisk kerne, mens polarhovedene, enden (-COO)- na+), interagere med vandmolekyler og skabe en "polar shell".
Ovennævnte er illustreret i billedet ovenfor, hvor denne type struktur kendt som micelle er vist.
De "svarte haler" svarer til de hydrofobe kæder, der bliver indviklet i en organisk kerne beskyttet af de grå kugler. Disse grå kugler udgør polarskærmen, hovedet -COO- na+.
Derefter er micellerne klynger (klynger) af salte af fedtsyrerne. Indenfor disse kan de omslutte fedt, hvilket er uopløseligt i vand på grund af dets apolære karakter.
Hvordan gør de det? Både fedt- og -R-kæderne er hydrofobe, så begge har stor affinitet for hinanden.
Når micellerne omslutter fedtene, interagerer vandet med polarskallen, hvilket tillader opløseligheden af sæbe. Ligeledes er micellerne negativt ladede, hvilket forårsager afstødninger til hinanden og derfor genererer dispersionen af fedtet.
referencer
- Anne Marie Helmenstine, Ph.D. (3. oktober 2017). Saponification Definition og Reaction. Hentet den 24. april 2018, fra: thoughtco.com
- Francis A. Carey. Organisk kemi Carboxylsyrer. (sjette udgave., s. 863-866). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organisk kemi. Lipider (10. udgave., Side 1056-1058). Wiley Plus.
- Wikipedia. (2018). Forsæbning. Hentet den 24. april 2018, fra: en.wikipedia.org
- Boyd C. (27. februar 2015). Forstå kæden og historien om sæbe. Hentet den 24. april 2018, fra: chemservice.com
- Luca laghi (27. marts 2007). Forsæbning. Hentet den 24. april 2018, fra: commons.wikimedia.org
- Amanda Hæklet (12. maj 2015). Micelle (gråtoner). Hentet den 24. april 2018, fra: commons.wikimedia.org


