Opløste egenskaber, forskelle med opløst og opløsningsmiddel, eksempler
den opløst stof, i en løsning,det er stoffet, som opløses i opløsningsmidlet. Generelt er det opløste stof fundet i en mindre andel, og kan være fast, flydende eller gasformig. Tværtimod er opløsningsmidlet komponenten af opløsningen, som er i mere mængde.
For eksempel er salt i saltvand i saltvand, og vand er opløsningsmidlet. Imidlertid er ikke alle opløste stoffer faste eller opløsningsmidler flydende.

I denne forstand er der flere mulige kombinationer af opløste stoffer og opløsningsmidler: gas i væske, fast stof, flydende i flydende væske, flydende i fast stof, fast i flydende eller faststof i fast stof.
For at genkende, hvad der er opløst i en løsning, skal der tages højde for to aspekter. For det første er det opløste stof substansen, der er mindre. Derudover er det den, der ændrer sin fysiske tilstand (fast, flydende eller gasformig), når den integreres i opløsningen.
indeks
- 1 Opløsninger, opløsningsmidler og opløste stoffer
- 2 Definition af opløst stof
- 3 egenskaber
- 3.1 Opløselighed
- 3.2 Temperatur
- 3.3 Mætning af en opløsning
- 3.4 Tryk
- 3,5 polaritet
- 4 Forskelle mellem opløst stof og opløsningsmiddel
- 5 Eksempler på opløst stof
- 5.1 Solutos i gasform
- 5.2 Solutos i fast tilstand
- 5.3 Solutos i flydende tilstand
- 5.4 Solutos, der kan bruges hjemme
- 6 referencer
Opløsninger, opløsningsmidler og opløste stoffer
I kemi er der homogene blandinger, som er de, der har deres komponenter opdelt i lige store mængder gennem deres indhold. En af de mest almindelige typer homogene blandinger er opløsninger, som er stabile homogene blandinger af to eller flere stoffer, hvor et opløst stof opløses i et opløsningsmiddel.
Opløsningerne, opløsningsmidlerne og opløste stoffer observeres i de daglige situationer og i en rækkevidde, der varierer fra industri til laboratorium. Disse stoffer dannet af blandinger er objekter af undersøgelse på grund af de egenskaber, de præsenterer, og de kræfter og / eller attraktioner, der opstår mellem dem..
Definition af opløst stof
Som nævnt ovenfor er et opløst stof det stof, der opløses i et andet, kaldet et opløsningsmiddel.
Normalt har opløst stof en mindre andel og kan forekomme i nogen af de tre tilstander af stof. Når der gives en løsning mellem to stoffer, der er i samme fase, anvendes metoden til at vælge den i en mindre andel til at definere, hvilket opløsningsmiddel der er, og som er opløsningsmidlet.
Opløsningskapaciteten af det opløste stof vil blive styret af opløseligheden. Temperaturen af opløsningsmidlet repræsenterer også en afgørende faktor, når det kommer til at kende muligheden for at danne eller ikke en opløsning, da jo højere opløsningsmiddelets temperatur er, desto større er mængden af opløst stof, der kan opløses i dette.
Der er stoffer kaldet overfladeaktive stoffer, der bliver mindre opløselige ved højere temperaturer, men de er undtagelser og opfylder bestemte roller.
Processen, hvori et opløsningsmiddel interagerer med et opløst stof til dannelse af en opløsning, defineres som solvation og involverer dannelse af bindinger og brintbroer ud over attraktionerne fra van der Waals-styrkerne.
funktioner
Opløsningerne omfatter et enormt udvalg af kemiske stoffer i forskellige tilstande, har forskellige opløsningskapaciteter og har mange karakteristika, der spiller en vigtig rolle i dannelsen af homogene blandinger. Nogle af de vigtigste egenskaber ved opløste stoffer er følgende:
opløselighed
Opløselighed er en sammensætnings evne til at opløse i et andet stof. Denne evne har et nært forhold til blandbarhed, hvilket er væskens evne til at blande sig med en bestemt; Hvis du ikke kan deltage, er det en blandbarhed.
Blandbarheden har en rækkevidde mere end et bestemt antal, så det kan siges at et stof er helt, delvist eller ikke blandbart i en anden.
Den opløselige egenskab af et opløst stof afhænger i sin tur af andre faktorer, som kan øge eller formindske denne kapacitet på grund af virkningen af disse på balancen mellem de intermolekylære kræfter, der opstår mellem opløst og opløsningsmiddel.
Endnu mindre forventede egenskaber, såsom størrelsen af en dråbe opløst eller rækkefølgen i en krystalstruktur, kan påvirke deres evne til at opløse.
temperatur
Temperaturen i det system, hvor et opløst stof opløses, kan påvirke dets opløselighed: for de fleste faste stoffer og væsker øger disse opløsningskapaciteten efter temperaturstigninger.
I modsætning hertil er der observeret en kompleks adfærd i gassen, som er vist som en lavere opløselighed i vand ved højere temperaturer, men en større i organiske opløsningsmidler.
Mætning af en opløsning
Det kaldes mætning af en opløsning i den grad, hvor en opløsning har opløst det opløste stof, kaldet en mættet opløsning til det, som har opløst så meget opløsning som muligt. Fra dette tidspunkt vil det tilsatte opløst stof bundfælde som et overskud i bunden af den brugte beholder; før dette kaldes opløsningen umættet.
Det er muligt at passere mætningspunktet og fortsætte med at opløse opløst stof, men det kræver en stigning i temperaturen. En opløsning, der indeholder et overskud af opløst stof, og som er opvarmet kaldes en overmættet opløsning.
tryk
Trykændringer normalt ikke påvirker opløseligheden af faste stoffer og væsker, bortset fra visse særlige tilfælde (akkumulering af calciumsulfat i olieledninger), men gas er en afgørende faktor for dets evne til at opløse.
Faktisk er opløseligheden af en gas i et opløsningsmiddel direkte proportional med partialtrykket af denne gas på opløsningsmidlet.
polaritet
Polariteten af et opløst stof er afgørende for måling af opløsningskapaciteten; et opløst stof opløses bedre i et opløsningsmiddel med kemisk struktur, der ligner den, den har.
For eksempel vil højt polære eller hydrofile stoffer have større opløselighed i stærkt polære opløsningsmidler, mens de vil være praktisk taget uopløselige i ikke-polære stoffer..
Tilsvarende intermolekylære kræfter spiller en vigtig rolle i solvatisering og den lethed, hvormed et opløsningsmiddel kan opløse et opløst stof: en større dipol-dipol kræfter, hydrogenbindinger og andre bindinger, jo større er evnen af opløsningsmidlet at opløse opløst og danner en opløsning.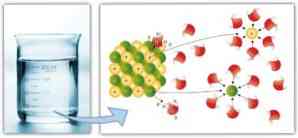
Forskelle mellem opløst stof og opløsningsmiddel
- Det opløste stof er det stof, der er opløst opløsningsmidlet er midlerne til at opløse det eller de opløste opløsningsmidler.
- Opløsningsmidlet kan være i fast, flydende eller gasfase; opløsningsmidlet er sædvanligvis i væskefasen, men det findes også i fast og gasformig.
- Opløseligheden af det opløste stof afhænger mere af egenskaber såsom overfladen; Solvat kapacitet afhænger af polaritet, temperatur og tryk blandt andre faktorer.
- Opløsningsmidlet er sædvanligvis den ønskede bestanddel, der skal ekstraheres i industrielle processer; Opløsningsmidlet er sædvanligvis ikke den ønskede komponent og kasseres i industrielle processer.
Eksempler på opløst stof
- Sukker er et eksempel på et fastfaset opløst stof, der typisk anvendes til at sødes vand.
- Hexan findes i paraffin voks, der tjener som et flydende opløste stof, der gør dette faste mere smidigt.
- Kuldioxid er en gas tilsat til drikkevarer for at give dem brus.
Solutos i gasform
Kuldioxid i vand (læskedrikke)
Carbonvand er vand, som indeholder kuldioxid, og produceres ved at føre kuldioxid under tryk gennem vand.
Kolsyret mineralvand forekommer naturligt i lang tid. Disse brusende farvande findes på grund af overskydende carbondioxid i en akvifer, der er opløst under tryk.
Et af de mest kendte eksempler på opløste stoffer er kommercielle læskedrikke, der kombineres med en sirup.
Tilstedeværelsen af kuldioxid gør disse farvande og læskedrikke mere appetitvækkende og visuelt tiltalende.
Oxygen og andre gasser i nitrogen (luft)
Luften i atmosfæren er sammensat af molekyler af forskellige gasser. Det består grundlæggende af 78% nitrogen og ca. 21% oxygen (opløst). Derudover indeholder den næsten 1% argon og andre molekyler, men i meget små mængder.
Propan i butan (madlavningsgas)
Denne kombination, også kendt som liquefied petroleum gas (LPG), begyndte at blive brugt siden 1860 som en kilde til brændsel til hjemmebrug..
Siden da har den udvidet sin produktion og forbrug til både indenlandsk og industriel brug. Fordi begge gasser er yderst lugtfrie og farlige, tilføjes et stof, der hedder mercaptan, hvilket gør en lækage mærkbar..
Solutos i fast tilstand
Kobberzink (messing)
Den kommercielle legering kendt som messing er dannet af zink (fra 5 til 40%) opløst i kobber. Zink hjælper med at øge trækstyrken. Andre elementer som tin, jern, aluminium, nikkel og silicium kan tilsættes til denne legering.
Jod i alkohol (tinktur af jod)
Et andet eksempel på solvat, der er populært kendt, er iodtinktur. Denne opløsning indeholder jod i ethylalkohol (fra 44 til 50%). Jodtinktur anvendes som et antiseptisk middel.
Salt i vand (havvand)
Havvand dækker mere end 70% af jordens overflade. Dette er en kompleks blanding af 96,5% vand, 2,5% salte og mindre mængder af andre stoffer. Dette omfatter uorganiske og opløste organiske materialer, partikler og nogle atmosfæriske gasser.
Solutos i flydende tilstand
Alkohol i vand (alkoholholdige drikkevarer)
Ethanol eller ethylalkohol (opløst stof) fra fermenteringen af sukker blandes med vand i faste proportioner for at producere alkoholholdige drikkevarer.
Denne forbindelse fordøjes let af kroppen, men forbruget i overskud kan forårsage alvorlige sundhedsskader.
Vand i luften (luftfugtighed)
Vand i luft er almindeligvis kendt som tåge. Dette skyldes små dråber vand suspenderet i luften, og skyldes i grunden afkøling af jorden om natten.
På denne måde får denne afkøling luften til at sænke temperaturen. Derefter opstår fænomenet, når kondenseret vand bevares i dette.
Eddikesyre i vand (eddike)
Eddike er en væske med en skarp smag, der bruges til at tilføje smag eller bevare mad. Den fremstilles ved en opløsning af eddikesyre blandet med vand.
Koncentrationen af eddikesyre er variabel. For eksempel har destilleret eddike en andel, der går fra 5 til 8%.
Kviksølv i sølv (amalgamer eller tandfyldninger)
Amalgamerne anvendt til tandfyldninger er dannet af 2% kviksølv med en legering, der virker som et opløsningsmiddel. Denne legering indeholder 70% sølv. Du kan også tilføje tin, kobber og zink.
Solutos, der kan bruges hjemme
Sukker i vand
Sukker er en molekylær og polær forbindelse, og som sådan har evnen til at opløse i vand, hvilket også er et polært element.
Den måde, hvorpå sukkeret er struktureret, vil medføre, at opløsningsprocessen varierer. For eksempel, hvis sukkeret er i klumper, vil det tage mere tid at opløse, end hvis det er i korn.
Nogle eksperter mener, at vand med sukker er en meget vigtig energikilde til kroppen. Der har endda været studier, der afslører effektiviteten af denne løsning hos mennesker, der udfører fysisk aktivitet.
Sukker i mel
Det er almindeligt for tilberedningen af en kage at blande de faste ingredienser først og derefter tilsæt væskerne.
Sukker er et opløst stof, der er fastgjort til melet, hvilket giver anledning til basisblandingen til kagen. Ud over disse to ingredienser tilføjes andre senere, såsom æg, smør eller vanille.
Denne type opløst stof er fast, og i dette tilfælde blandes det med et opløsningsmiddel, som også er fast. Den resulterende base kan også bruges til at lave søde brød, kager, kager, svampekager, små puddinger og mange andre søde fødevarer.
Juice pulver i vand
Der er en bred vifte af pulveriseret saft, der fremstilles ved at opløse dette element i vand. I dette tilfælde er opløsen saftpulveret, og opløsningsmidlet er vandet.
Mængden af opløsningsmiddel skal være større end opløsningsmidlets opløsning, så normalt opløses en eller to spiseskefulde pulver af juice i et glas vand. Selv er der nogle pulvere, hvis koncentration er højere og en mindre mængde bør anvendes.
Der er forstyrrelser af disse saft, da de indikerer, at de komponenter, de indeholder (som konserveringsmidler, stabilisatorer og sødemidler, blandt andre) er sundhedsskadelige.
Klor i vand
En måde at rense vand på er at bruge klor som et opløst opløsemiddel i vand. Dette desinfektionsmiddel er karakteriseret ved at være en af de mest anvendte til at fjerne mikrober, og det er ideelt at gøre ikke-drikkevand til drikkevand på en hurtig, økonomisk og nem måde.
Klor som et opløst stof af denne opløsning bør inkorporeres i vand i en koncentration ikke højere end 0,2 og 0,5 mg pr. Liter.
Mængden af chlor, der skal anvendes, skal være meget lav, fordi dette stof kan være yderst giftigt, når det indtages eller udsættes for mange mængder.
Denne metode til rensning af vand er kendt som chlorering og kan anvendes i midten af en udflugt til bjerget eller for at behandle vandet i hjemmet for at eliminere bakterier og mikrober, der kan findes i de rør, gennem hvilke vandet passerer..
Maling i vand
Vand er det mest universelle opløsningsmiddel, der eksisterer, og det er også grundlaget for, at et opløst stof som maling kan opløse.
Malingen opløses normalt af forskellige årsager. Det mest almindelige er at lette rengøringen af børster og andre værktøjer, der bruges til at male.
Der er mange typer malerier; De, som bedst opløses i vand, er latexerne. Ud over at tillade en bedre rengøring af værktøjerne, er fordelen ved at fortynde malingen i vand inden man begynder at male, at den sikrer en bedre finish på den malede overflade.
Mælkepulver i vand
Mælkepulver er et opløst stof, der dannes gennem dehydrering af mælk, der allerede er pasteuriseret. Formålet med denne proces er at sikre, at mælken kan opbevares bedre i længere tid.
Dette opløst opløses i vand og frembringer flydende mælk, som almindeligvis indtages til morgenmad sammen med kaffe eller i forskellige præparater.
Som i saftpulver skal mængden af mælk, der skal fortyndes, være mindre end den mængde vand, i hvilket du vil forberede opløsningen.
Vaskemiddel i vand
Ved vask af tøj anvendes væske eller pulvervaskemidler. Disse opløses i vand for at danne en opløsning, der fungerer som et desinfektionsmiddel og rengøringsmiddel af tekstilstof.
Mængden af opløst stof, der skal anvendes i denne opløsning, er variabel afhængigt af detergentets type, præsentationen af det samme og de komponenter, den har.
Løsningen, der består af vaskemiddel og vand, kan være meget forurenende, når det kommer i kontakt med vanddumper, så det er tilrådeligt at bruge biologisk nedbrydelige vaskemidler, som kan blive forringet på meget kort tid og påvirke langt mindre miljøet.
gelatine
Gelatine er et element bestående af sener, ledbånd og dyr knogler. Denne forbindelse kan være i pulver eller i plader.
I begge tilfælde skal dette opløst opløses i varmt vand for at opnå det endelige resultat: en sød mad ideel til dessert og med mange sundhedsmæssige fordele.
Blandt fordelene ved denne forbindelse er, at den favoriserer hurtig vævsreparation og er en antiinflammatorisk mad. Derudover har den en stor mængde proteiner og spiller en vigtig rolle i befæstningen af immunsystemet.
Spise en lille daglig mængde gelatine vil hjælpe med at regenerere leddene og således forudse udseendet af osteoporose.
Chokolade i mælk
Chokolade er et element, der dannes takket være blandingen af kakao og kakaosmør. Denne mad virker som et opløst stof, når det blandes med mælk for at forberede det, der almindeligvis kaldes varm chokolade.
Til dette præparat opvarmes den ønskede mængde mælk, og chokoladen tilsættes i stykker i pulver eller væske under konstant omrøring.
For at dette opløste opløsning skal løses på bedst mulig måde og undgå klumperne, er det nødvendigt at slå blandingen uden pause.
Kakaopulver i vand
Du kan også forberede varm chokolade ved hjælp af kakaopulver. Dette opløst stof er kun dannet af massen af den pulveriserede kakao. I modsætning til chokolade omfatter kakao ikke smør af denne frugt.
Kakao kan opløses helt i vand for at fremstille en chokoladefarvet drikkevare. I disse tilfælde er det vigtigt at sødes blandingen med sukker, honning eller noget sødemiddel; ellers vil resultatet være ekstremt bittert.
referencer
- Lambert, N. og Mohammed, M. (1993). Kemi til CXC. Oxford: Heinemann.
- Steen, D. P. (2008). Kuldioxid, karbonering og principperne for påfyldningsteknologi. I D. P. Steen, Philip og P. R. Ashurst (redaktører), Carbonated Soft Drinks: Formulation and Manufacture, pp. 112-143. Oxford: Blackwell Publishing.
- Hvad er der i luften? (s / f). UCAR Center for Science Education. Hentet den 17. oktober 2017, fra eo.ucar.edu
- Liquefied petroleumgas. (2013, 12 juli). Encyclopædia Britannica.
Hentet den 16. oktober 2017, fra britannica.com - Lytle, D. A. og Schock, M. R. (1996). Stagnationstid, sammensætning, PH og ortophosphateffekter på metaludvaskning fra messing. Ohio: U.S. Miljøstyrelsen.
- Crabwee, T. D .; Pelletier, S.J. og Pruett, T. L. (2001). Kirurgisk antisepsis I S. S. Block (redaktør), Desinfektion, Sterilisering og Bevarelse, pp. 919-934. Philadelphia: Lippincott Williams & Wilkins.
- Byrne, R. H. et al. (2017, juni 07). Havvand. Encyclopædia Britannica. Hentet den 17. oktober 2017, fra britannica.com
- Plutowska B. og Wardencki, W. (2012). Gaskromatografi-olfaktometri af alkoholholdige drikkevarer. I J. Piggott (redaktør), Alkoholholdige Drikkevarer: Sensorisk Evaluering og Forbrugerforskning, s.101-122. Philadelphia: Woodhead Publishing.
- Hvad er tåge? (2017, juli 12). Met Office (UK). metoffice.gov.uk
- Helmenstine, A. M ... (2016, 16. februar). Hvad er den kemiske sammensætning af eddike? Hentet den 17. oktober 2017, fra thoughtco.com
- Phinney, D.J. og Halstead, J.H. (2017). Tandhjælp: En omfattende tilgang. Massachusetts: Cengage Learning.
- Britannica, E. (s.f.). Løsning-kemi. Hentet fra britannica.com
- Wikipedia. (N.D.). Opløselighed. Hentet fra en.wikipedia.org
- Classzone. (N.D.). Opløste stoffer. Hentet fra frsd.k12.nj.us
- ChemGuide. (N.D.). Mættede løsninger og opløselighed. Hentet fra chem.libretexts.org
- Madhusha. (N.D.). Forskel mellem opløsningsmiddel og opløsning. Hentet fra pediaa.com.


