Natriumsulfidformler, anvendelser, risici
den natriumsulfid (Na2S) er et krystallinsk faststof fra gul til mursten rød. I naturen findes den i forskellige grader af hydrering, idet den er den mest almindelige natriumsulfid nonahydrat (Na2S · 9H2O).
De er vandopløselige salte, der giver stærkt alkaliske opløsninger. Når de udsættes for fugtig luft, absorberer de fugt fra luften, som kan spontant varme op og forårsage antændelse af nærliggende brændbare materialer. Ligeledes i kontakt med fugtig luft udsender de hydrogensulfid, som lugter som rotte æg.

De er stærke reduktionsmidler. Disse stoffer kan være miljøfarlige, især for vandorganismer.
Natriummonosulfid er kommercielt tilgængeligt i form af flager indeholdende 60-62% Na2S ...
- formler

- CAS: 1313-82-2 Natriumsulfid (vandfri)
- CAS: 1313-84-4 Natriumsulfid (ikke-hydreret)
2D struktur
3D struktur
Karakteristik af natriumsulfid
Fysiske og kemiske egenskaber

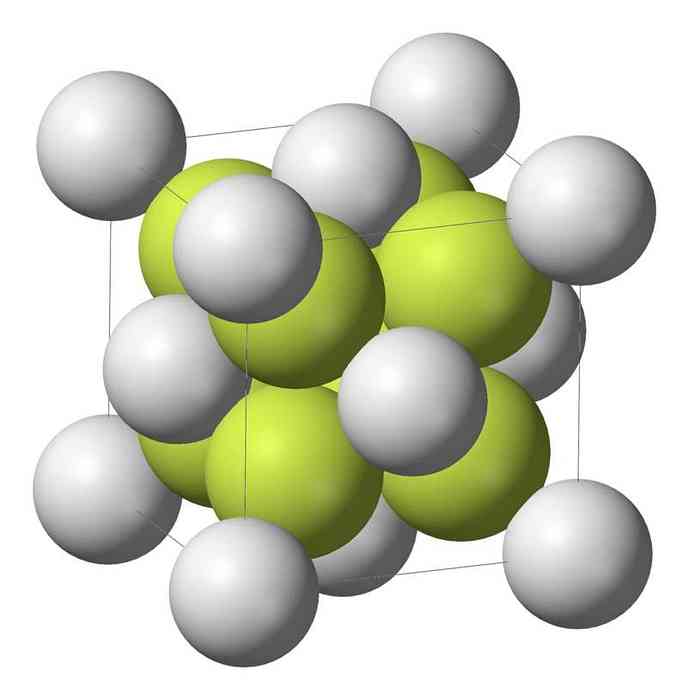
Natrium monosulfid (Na2S) krystalliserer med antifluorite struktur, hvor hver S-atom er omgivet af et nav 8 Na-atomerne og hver Na-atomet ved en tetraeder af fire S-atomer.
antændelighed
Det eneste stærkt brændbare element i gruppen af uorganiske sulfider er hydrogensulfid. Imidlertid kan nogle andre uorganiske sulfider, såsom natriumsulfid, spontant varme op og endda antændes hvis de udsættes for fugt..
Ved udsættelse for brand afgiver natriumsulfid gasser eller dampe af svovldioxid, som er irriterende eller giftige.
reaktivitet
- Uorganiske sulfider er generelt basale (nogle er stærkt basiske og derfor uforenelige med syrer).
- Mange af disse forbindelser er reduktionsmidler (de reagerer kraftigt med oxidationsmidler).
- Sulfider simple salte (såsom natriumsulfid, kalium og ammonium) reagere voldsomt med syrer til frigivelse hydrogensulfidgas, meget giftigt og brændbart.
- Natriumsulfid er brandfarlig. Kan eksplodere, når det opvarmes hurtigt eller rammes.
- Når den opvarmes til nedbrydning, udsender den giftige dampe af natriumoxid og svovloxider.
- Reagerer voldsomt med kulstof, med trækul, diazoniumsalte, N, N-dichlormethylamin, stærke oxidanter og vand.
toksicitet
Mange medlemmer af gruppen uorganiske sulfider opfører sig som stærke baser og kan forårsage alvorlige forbrændinger, når de kommer i kontakt med huden.
Denne egenskab afhænger af dets opløselighed. De mest uopløselige uorganiske sulfider (fx kviksølv (II) sulfid og cadmiumsulfid) er ikke kaustiske.
Natriumsulfid har et oktanol / vand partitionskoefficient (Pow) medium (-3,5). Denne værdi anvendes som et mål for opløseligheden (og biokoncentrationen) af et stof i animalske fedtvæv (især vanddyr).
Natriumsulfid anses for at være farligt for miljøet, især for vandorganismer.
applikationer
Derhjemme er natrium sulfid benyttes i afløb oplukker, rengøringsmidler (for ovnen, badeværelset), håret, opvaskemiddel og bil airbags.
I industrien bruges den i rengøringsmidler, i cement og som forløber i produktionen af andre kemiske produkter.
Kliniske virkninger
Eksponering for natriumsulfid er almindelig i udviklede lande og underudviklede lande, både i industrien og i hjemmet. Disse ætsende stoffer er til stede i flere husholdningsvarer i lav koncentration.
I udviklede lande er alvorlige virkninger sjældne. Disse forekommer hovedsageligt på grund af bevidst indtagelse af kemikaliet hos voksne. Men i udviklingslandene er alvorlige virkninger mere almindelige.
Alkaliske ætsende stoffer forårsager nekrose på grund af kondensation. Saponify fedtene i cellemembranen, ødelægge cellen og tillade dyb penetration i slimhindevævets væv.
Oral eksponering
Initial inflammation opstår i gastrointestinalt væv, efterfulgt af vævsnekrose (med mulig perforering), derefter granulering og endelig stenose formation.
Patienter med mild indtagelse udvikler irritation eller grad jeg forbrænder (overfladisk hyperæmi og ødem) i oropharynx, spiserøret eller maven.
Patienter med moderat forgiftning kan udvikle klasse II-forbrændinger (overfladiske blærer, erosioner og sårdannelser) med mulig yderligere dannelse af stenose (især spiserør).
Nogle patienter (især små børn) kan udvikle ødem i de øvre luftveje.
Patienter med alvorlig oral toksicitet kan udvikle dybe forbrændinger og nekrose af den gastrointestinale slimhinde, med komplikationer såsom perforering (esophageal, gastrisk, duodenal sjælden gang), fistler (tracheoesophageal, aortoesophageal) og gastrointestinal blødning.
kan udvikle hypotension, takykardi, takypnø, strikturdannelse (hovedsagelig i spiserøret), esophageal carcinoma og ødem i de øvre luftveje (som er fælles og ofte livstruende).
Alvorlig forgiftning er generelt begrænset til bevidst indtagelse hos voksne.
Eksponering ved indånding
Mild eksponering kan forårsage hoste og bronchospasme.
Alvorlig indånding kan forårsage ødem i øvre luftveje, forbrændinger, stridor og sjældent akut lungeskade.
Øjeneksponering
Det kan producere alvorlig conjunctival irritation og kemose, hornhindeepiteldefekter, limbisk iskæmi, permanent visuelt tab og i alvorlige tilfælde af perforering..
Hudkontakt
Mild eksponering forårsager irritation og forbrændinger i partikler. Metabolisk acidose kan udvikles hos patienter med alvorlige forbrændinger eller chok.
Langvarig eksponering eller højkoncentrationsprodukter kan forårsage total tykkelse af forbrændinger.
Sikkerhed og risici
Fareerklæringer for det globalt harmoniserede system til klassificering og mærkning af kemikalier (SGA)
Den globale harmoniserede system for klassificering og mærkning af kemikalier (GHS) er en internationalt anerkendt system, skabt af De Forenede Nationer og designet til at erstatte de forskellige klassificering og mærkning standarder, der anvendes i forskellige lande ved at bruge globalt ensartede kriterier.
Hazard klasser (og dens tilsvarende kapitel i GHS) standarder klassificering og mærkning og anbefalinger natriumsulfid er (Det Europæiske Kemikalieagentur, 2017 FN, 2015; pubchem, 2017):







referencer
- Benjah-bmm27, (2006). Fluorit-enhed-celle-3D-ionisk [billede] Hentet fra: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [billede] Hentet fra: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D struktur af 1313-82-2 - Natriumsulfid [billede] Hentet fra: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D struktur af 1313-84-4 - Natriumsulfid [billede] Hentet fra: chem.nlm.nih.gov.
- Det Europæiske Kemikalieagentur (ECHA). (2017). Oversigt over klassificering og mærkning.
- Harmoniseret klassificering - Bilag VI til forordning (EF) nr. 1272/2008 (CLP-forordningen). Natriumsulfid. Hentet den 16. januar 2017, fra: echa.europa.eu.
- Det Europæiske Kemikalieagentur (ECHA). (2017). Oversigt over klassificering og mærkning.
- Notificeret klassificering og mærkning. Natriumsulfid, hydreret. Hentet den 16. januar 2017, fra: echa.europa.eu.
- Datablad for farlige stoffer (HSDB). TOXNET. (2017). Natriumsulfid. Bethesda, MD, EU: National Library of Medicine. Hentet fra: toxnet.nlm.nih.gov.
- Lange, L., & Triebel, W. (2000). Sulfider, polysulfider og sulfaner. I Ullmanns Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. Hentet fra dx.doi.org.
- De Forenede Nationer (2015). Globalt Harmoniseret System til Klassificering og Mærkning af Kemiske Produkter (SGA) Sjette Revideret Udgave. New York, USA: FN-publikation. Hentet fra: unece.org.
- National Center for Bioteknologi Information. PubChem Compound Database. (2016). Sodium Sulfide Enneahydrate - PubChem Structure [billede] Hentet fra: pubchem.ncbi.nlm.nih.gov.
- National Center for Bioteknologi Information. PubChem Compound Database. (2017). Natriummonosulfid. Bethesda, MD, EU: National Library of Medicine. Hentet fra: pubchem.ncbi.nlm.nih.gov.
- National Center for Bioteknologi Information. PubChem Compound Database. (2017). Natriumsulfid enneahydrat. Bethesda, MD, EU: National Library of Medicine. Hentet fra: pubchem.ncbi.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Kemisk datablad. Natriumsulfid, vandfri. Silver Spring, MD. EU; Hentet fra: cameochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Reaktivt gruppedatablad. Sulfider, uorganiske. Silver Spring, MD. EU; Hentet fra: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [billede] Hentet fra: wikipedia.org.
- PubChem, (2016). Natriummonosulfid [billede] Hentet fra: puchem.nlm.nih.gov.
- PubChem, (2016). Natriumsulfid enneahydrate [billede] Hentet fra: puchem.nlm.nih.gov.
- Wikipedia. (2017). Octanol-vand-partitionskoefficient. Hentet 17 januar 2017, fra: wikipedia.org.
- Wikipedia. (2017). Natriumsulfid. Hentet 17 januar 2017, fra: wikipedia.org.


