Manganoxid (MnO2) Kemisk struktur, egenskaber og anvendelser
den manganoxid (MnO2) er en uorganisk kemisk forbindelse dannet af element manganet med et oxidationsnummer +4 og oxygen, som i dannelsen af oxider har et oxidationsnummer på -2. Det er også kendt ved navnene på mangan (IV) oxid og mangananhydrid.
Det er et fast stof fra mørk til sort kaffe. Det er naturligt som mineralpirolusit, sorte og krystalliserede formende dendritter (forgrenede forlængelser). Det kan opnås som en sort rest i reaktionen mellem ethylen og kaliumpermanganat efter dannelsen af glycol ved oxidation af kaliumpermanganat.

Det er meget vigtigt i glasindustrien på grund af sin natur oxidationsmiddel, det eliminerer grønne fra ferroforbindelser og konverterer ferri.
indeks
- 1 Kemisk struktur
- 2 Egenskaber
- 3 anvendelser
- 3.1 Som katalysator
- 4 Virkninger på sundheden
- 5 referencer
Kemisk struktur
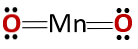
Den kemiske struktur af forbindelsen svarer til et anhydrid og ikke af en basisk oxid, som det forventes af være dannet af et metal og en ikke-metallisk.
Denne særlige sag skyldes den adfærd, som mangan indtager i de forskellige oxidationstilstande, den har. Således for oxideringsstaten +2 og +3 dannes oxiderne MnO og Mn2O3 henholdsvis at de omsætter med vand henholdsvis henholdsvis manganhydroxid og manganhydroxid.
Men Mn2O3 i et lidt surt medium opfører det sig som et anhydrid. Med oxidationstilstandene +4, +6 og +7, MnO2, MnO3 og MnO4 de danner syrer, når de omsættes med vand.
I et let surt medium er MnO2 Det opfører sig som et basisk oxid, så det kan danne det tilsvarende hydroxid.

Husk, at i dette tilfælde ingen omtale af amfotere egenskaber, ifølge hvilken en forbindelse kan opføre sig som en syre eller en base. Dette er et specielt tilfælde af Mn-adfærd.
egenskaber
applikationer
- Det bruges som en kilde til mangan
- Som oxidant i alkaliske batterier
- Maling til glas, keramik og porcelæn.
- Ved opnåelse af chlor og iod.
- Ved nedbrydning af hydrogenperoxid til dannelse af gasformigt ilt og vand.
- I dekomponeringsreaktionen af kaliumchlorat til fremstilling af gasformigt ilt og kaliumchlorid.
- Opløst i acetone eller i dichlormethan, oxiderer primære alkoholer til aldehyder og sekundært til ketoner.
- Fremstilling af alkaliske batterier.
Som katalysator
Dette gælder for oxidreduktionsreaktioner til fjernelse af sulfider såsom H2S og kationer som Fe+2 og Mn+2 , arsen og radio fundet i grundvand, der er forurenet af denne type forbindelser.
Denne forurening kan genereres enten ved ukontrolleret dumping af giftige materialer ved at vaske forurenet jord eller ved tilstedeværelsen af kemiske elementer på tidspunktet for udvindingen af vand.
MnO2 høj renhed opnået brunsten anvendt som filter (Filox) er det mest effektive middel til at fjerne denne klasse af urenheder fra grundvand.
Virkninger på sundheden
- Undgå kontakt med huden.
- I tilfælde af kontakt, vask det tilsvarende område.
- Indånd ikke pulveret.
- Irritation og rødme kan ses ved øjenkontakt. Vask med rigeligt vand, lad vandet løbe gennem øjnene og ring til lægehjælp i tilfælde af alvorlig skade.
- I kontakt med huden er irritation og rødme observeret. Vask det berørte område med rigeligt vand og sæbe.
- Langvarig hudkontakt fjerner dit naturlige fedt, der udløser en dermatitis.
- Indånding kan forårsage en influenzalignende tilstand (metalliske dampe). Tilstanden er karakteriseret ved høj feber, kuldegysninger, tør mund og hals, muskelsmerter og hovedpine.
- Det kan irritere luftveje og øge forekomsten af luftvejsinfektioner (lungebetændelse). Intoxikation ved absorption af uorganiske mangansalte gennem lungerne er usandsynligt, men kronisk forgiftning kan forekomme.
- Kronisk udsættelse for støv eller røg fra mangandioxid i lang tid kan påvirke centralnervesystemet og føre til udvikling af Parkinsons sygdom, vandbesvær, muskelspasmer og adfærdsændringer.
- Indtagelse kan forårsage mavesmerter og kvalme.
- Det er ikke brandfarligt, men det hjælper med at brænde ilden i glødelamperne. Ved opvarmning til en temperatur over 535 ° C nedbrydes stoffet til manganoxid (III) Mn2O3 og ilt, som er brandfarlig og øger faren for brand. I dette tilfælde skal ilden slukke med skum eller kuldioxid.
- I tilfælde af spild må man ikke manipulere forbindelsen uden passende personlig beskyttelse.
- Gemme forbindelsen i lukkede beholdere i et køligt og tørt sted væk fra stoffer, som er uforenelige ham som organisk materiale og brændbart materiale.
- Opbevaringsstedet skal være tørt og have gulve, der er resistente over for syrekorrosion og med god dræning..
- Personligt beskyttelsesudstyr skal anvendes som handsker, sikkerhedsbriller, antistøvfiltermasker, støv og røg.
referencer
- B, (2015), Mangandioxid, The Royal Society of Chemistry - Kemisk verden, hentet fra chemistryworld.com
- Karal, (2014), Mangneso Dioxide, Sikkerhedsdatablad, Gendannet fra, karal.com.mx
- Din virtuelle lærer (2015/02/25). Manganorganiske forbindelser (special case 1) - Teoretisk lektion), hentet fra youtube.com
- Ecured, (s.f), Mangandioxid, Recovered from ecured.cu
- Angarita G, Johnny., (2017), Mangandioxid: En Enestående Teknologi. Hidroteco, udvundet fra hydrotecocr.com
- Fernández, G., (2015), MnO Mangandioxid2/ acetone, Organisk kemi, Genoprettet fra quimicaorganica.net
- Tronox, (2011), Mangandioxid, Sikkerhedsdatablad, Gendannet fra, Tronox.com


