Atomisk Model af Dalton Postulates
den Daltons atommodel eller Daltons atomteori, Det var et forslag præsenteret mellem 1803 og 1807 af den engelske kemiker og matematiker John Dalton. Dette var det første forslag om konceptuel organisation vedrørende atomernes struktur og funktion.
Dalton-modellen er også kendt som en sfærisk model, da den foreslår, at atomet er en udelelig, fast og kompakt kugle. Takket være denne model var det meget nemmere at give en forklaring om kemi til resten af verden, og det var grundlaget for de mange innovative forskningsprojekter, der fulgte. Kunne forklare, hvorfor stoffer reagerede i visse stater.
Ifølge Dalton var materien sammensat af en minimal enhed kaldet atom, som ikke kunne ødelægges eller opdeles på nogen måde. Denne enhed, som tidligere blev foreslået af Democritus og hans mentor Leucipo, var grundlaget for Daltons forskning og oprettelsen af hans atommodel.
Med denne atomteori forsøgte John Dalton at opfatte de græske filosofferes ideer om atomets eksistens (atomteorien om universet), men som platform anvendte forskellige laboratorieforsøg, som gjorde det muligt for ham at demonstrere sine ideer.
indeks
- 1 Postulater af Dalton Atomic Model
- 1.1 Postulat 1
- 1.2 Postulat 2
- 1.3 Postulat 3
- 1.4 Postulat 4
- 1,5 Postulat 5
- 1.6 Postulat 6
- 2 fejl i Daltons atomormodel
- 2.1 Vandformel
- 2.2 Sammensætning af atomer
- 3 Konklusioner
- 4 Daltons vigtigste bidrag
- 4.1 Forløber af atomteorier
- 4.2 Han lagde grundlaget for moderne kemi
- 4.3 For det første at offentliggøre en tabel af kemiske vægte
- 4.4 Giv navn til farveblindhed
- 5 Artikler af interesse
- 6 referencer
Postulater af Dalton Atomic Model
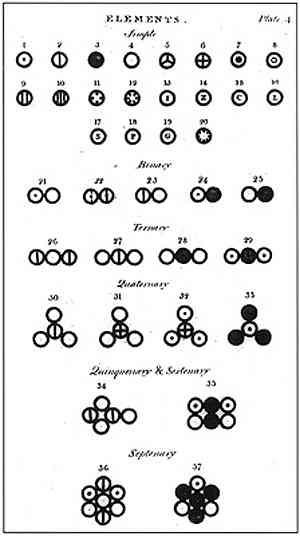
Dalton formulerede sin atommodel med 6 postulater, hvor han forklarer, hvordan han baserede sine studier og hvordan han bar dem ud.
Postulat 1

I ovenstående billede er et resumé af Daltons model repræsenteret: atomer ville være små sfærer udelelig, uforgængelig og homogen.
Daltons første postulat angav, at elementerne består af små partikler kaldet atomer, som ikke kan deles eller kan ødelægges.
Dalton kommenterede også, at disse partikler ikke kunne ændre sig i nogen kemisk reaktion.
Postulat 2

Daltons andet postulat fastslog, at alle atomer, der er til stede i et samme element, er ens i vægt som i andre egenskaber.
På den anden side fastslog det også, at atomer af forskellige elementer har forskellig masse. Fra dette forslag opstod viden om de relative atomvægte, der blev påvist ved sammenligning af forskellige elementer med hydrogen.
Postulat 3

Daltons tredje postulat fastslår at atomer er udelelige, selv når de kombineres i kemiske reaktioner. De kan heller ikke skabes eller ødelægges.
Kombinationen af atomer, både lige og forskellige, vil generere mere komplekse forbindelser, men denne proces vil ikke ændre det faktum at atomet er den mindste enhed af stof.
Postulat 4
Det fjerde postulat af Dalton fastslog, at selv når atomer kombineres til dannelse af en forbindelse, vil de altid have en relation, der kan udtrykkes i enkle og komplette tal. Dette udtryk vil ikke blive vist i fraktioner, da atomerne er udelelige.
Postulat 5
Daltons femte postulat angav, at der er en mulig kombination af forskellige atomer i forskellige proportioner for at danne mere end en forbindelse.
På den måde kan det forklares, at alt det eksisterende stof i universet er kommet fra en fin mængde atomer.
Postulat 6
Daltons sjette og endelige postulat erklærede, at hver eneste kemiske forbindelse blev skabt ud fra kombinationen af atomerne af to eller flere forskellige elementer.
Fejl af Dalton Atomic Model
Ligesom alle teorier i videnskabens verden var der mange refutations med hensyn til modellen foreslået af Dalton, som blev demonstreret gennem årene efterlade de innovative ideer fra Dalton.
Vandformel
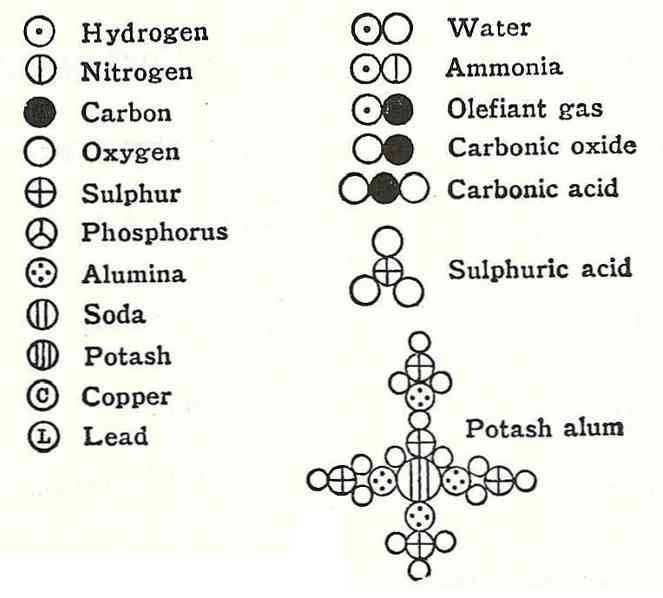
Et eksempel på dette var argumentet fra Dalton om vandens formel, som han sagde var sammensat af et hydrogen og en ilt.
På grund af denne erklæring var der mange fejlberegninger med hensyn til massen og vægten af nogle basiske forbindelser, der var baseret på disse oplysninger.
Nogle få år senere afviste de europæiske forskere Gay-Lussac og Alexander von Humbodt disse oplysninger og beviste, at vand faktisk var sammensat af to hydrogener og en ilt. 6 år senere påpegede Amadeo Avogadro den nøjagtige sammensætning af vandet og på grund af det er der loven om Avogadro.
Sammensætning af atomer
På den anden side blev i det tyvende århundrede den sande sammensætning af atomer afsløret. I dette tilfælde blev det vist, at der er en mindre enhed som protoner, elektroner og neutroner.
På samme måde kom eksistensen af de forskellige atomvægte, der var etableret i det periodiske bord af Mendeleev og Meyer, eksistensen af isotoper og de mere specifikke kemiske egenskaber, op.
konklusioner
På trods af hans fejl var John Daltons bidrag af stor relevans i videnskabens verden og forårsaget en rystelse i hans tid på grund af den store mængde information, han gav.
Dine videnskabelige bidrag er stadig gyldige og undersøges stadig.
Den atompolitiske model af Dalton blev ikke sat spørgsmålstegn ved i årtier på grund af dens relevans i videnskabens verden og dens korrekte forklaring på de undersøgelser og hypoteser, der blev præsenteret på det tidspunkt i videnskabens historie.
Daltons vigtigste bidrag
Hans bidrag til videnskabens verden var primært at klarlægge og formulere hypoteser om naturen gennem kvantitative tests.
Forskeren døde af et hjerteanfald den 27. juli 1884 i Manchester og kort efter modtog æresbevisninger fra monarkiet.
Forløber af atomteorierne
John Dalton var en engelsk kemiker, matematiker og kemiker. Han blev født den 6. september 1766 i Cumberland, Det Forenede Kongerige, og er kendt som en af forstadierne af atomteorier fra det øjeblik han præsenterede sin Atomic Model..
Han lagde grunden til moderne kemi
Dalton er kendt som en af forløberne i at skabe et bord af relative vægte for kemiske elementer. Denne kendsgerning bidrog til at lægge grundlaget for det, vi kender i dag som moderne kemi.
Først for at udgive en tabel af kemiske vægte
Dalton var den første videnskabsmand, der havde den ære at udgive et bord af atomvægte, der indeholdt elementer som hydrogen, ilt, fosfor, kulstof og svovl. Takket være denne publikation begyndte Dalton at arbejde og til at forme, hvad der ville være hans atommodel.
Giv navn til farveblindhed
Det skal bemærkes, at Dalton var en af de første personer, der var registreret med visuelle problemer for at indfange farverne, og som følge af denne tilstand betegnes denne farveblindhed.
Artikler af interesse
Atom model af Schrödinger.
Atomisk model af Broglie.
Atom model af Chadwick.
Atommodel af Heisenberg.
Atomisk model af Perrin.
Atommodel af Thomson.
Atomisk model af Dirac Jordan.
Atomisk model af Democritus.
Atom model af Bohr.
referencer
- Daltons atomteori. Hentet den 24. november 2017, fra Khanacademy: www.khanacademy.org
- Daltons atomteori. Hentet den 24. november 2017, fra Indiana University Northwest: iun.edu
- Atomteori. Hentet den 24. november 2017, fra Encyclopædia Britannica: www.britannica.com
- Atomteori. Hentet den 24. november 2017, fra Wikipedia: en.wikipedia.org
- Atomstrukturens historie. Hentet den 24. november 2017, fra Lumen: courses.lumenlearning.com.


