Broglie Atomic Model Egenskaber og Begrænsninger
den Broglie atommodel blev foreslået af den franske fysiker Louis Broglie i 1924. I sin doktorafhandling, sagde han Broglie bølge-partikel dualitet af elektroner, om grundlaget for bølgemekanik. Broglie offentliggjorde vigtige teoretiske fund om stoffets bølgekorpsulatur ved atomskalaen.
De Broglie senere erklæringer eksperimentelt påvist af forskere Clinton Davisson og Lester Germer i 1927. bølge teori om elektron de Broglie er baseret på Einsteins forslag på den bølge egenskaber af lys med korte bølgelængder.
Broglie annoncerede muligheden for, at sagen havde en adfærd, der lignede lysets, og foreslog lignende egenskaber i subatomære partikler som elektroner.
Elektriske ladninger og kredsløb begrænser amplitude, længde og frekvens af den bølge, der er beskrevet af elektroner. Broglie forklarede bevægelsen af elektroner omkring atomkernen.
indeks
- 1 Karakteristik af Broglie atommodellen
- 2 Davisson og Germer eksperiment
- 3 begrænsninger
- 4 Artikler af interesse
- 5 referencer
Karakteristik af Broglie atommodellen
For at udvikle sit forslag startede Broglie fra princippet om, at elektroner havde en dobbelt karakter mellem bølge og partikel, ligner lys.
På denne måde lavede Broglie en sammenligning mellem begge fænomener og baserede på de ligninger, som Einstein udviklede til undersøgelsen af lysets bølgeform, angav han følgende:
- Den totale energi af foton og dermed den samlede energi af elektronen er produktet af hyppigheden af bølgen og Plancks konstant (6.62606957 (29) × 10 -34 Jules x sekunder), som beskrevet i følgende udtryk:
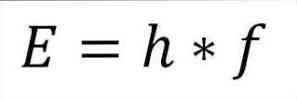
I dette udtryk:
E = elektronenergi.
h = Plank konstant.
f = frekvens af bølgen.
- Fremdriften af foton, og derfor elektronen er omvendt proportional med bølgelængden, og begge størrelserne er relateret af Plancks konstant:
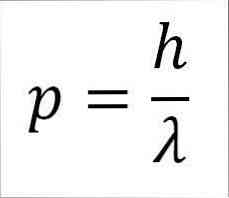
I dette udtryk:
p = lineært øjeblik for elektronen.
h = Plank konstant.
λ = bølgelængde.
- Det lineære momentum er produktet af massen af partiklen med den hastighed, som partiklen har under dens forskydning.
Hvis det tidligere matematiske udtryk er omstruktureret som en funktion af bølgelængden, har vi følgende:
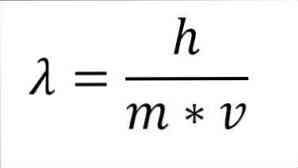
I udtrykket:
λ = bølgelængde.
h = Plank konstant.
m = elektronens masse.
v = elektronhastighed.
Siden h, Plankkonstanten har en lille værdi, er bølgelængden λ også. Følgelig er det muligt at angive, at elektronens bølgeegenskaber kun forekommer på atom- og subatomære niveauer.
- Broglie er også baseret på postulaterne af Bohrs atommodel. Ifølge sidstnævnte er elektronernes kredsløb begrænsede og kan kun være multipler af heltal. således:
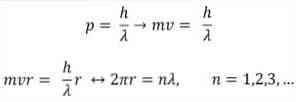
hvor:
λ = bølgelængde.
h = Plank konstant.
m = elektronens masse.
v = elektronhastighed.
r = baneets radius.
n = hele tal.
Ifølge Bohr model, som Broglie vedtaget som en basis, hvis elektronerne opfører sig som stående bølger, de kun tillod baner er dem, hvis radius er lig med et helt multiplum af bølgelængden λ.
Derfor opfylder ikke alle kredsløb de parametre, der er nødvendige for, at en elektron kan bevæge sig gennem dem. Derfor kan elektronerne kun rejse i bestemte baner.
Wave teori elektron de Broglie berettiget succes Bohr model til at forklare adfærd enkelt elektron af hydrogenatomet.
Analogt kaster det også lys på, hvorfor denne model ikke passede mere komplekse systemer, det vil sige atomer med mere end en elektron.
Davisson og Germer eksperiment
Den eksperimentelle verifikation af Broglie-atommodellen fandt sted 3 år efter offentliggørelsen, i 1927.
De fremtrædende amerikanske fysikere Clinton J. Davisson og Lester Germer bekræftede eksperimentelt teorien om bølgemekanik.
Davisson og Germer udførte spredningstest af en elektronstråle gennem en nikkelkrystal og observerede diffraktionsfænomenet gennem metalmediet.
Det udførte forsøg bestod i at udføre følgende procedure:
- I første omgang blev der anbragt en samling med elektronstråle, der havde en kendt startenergi.
- En spændingskilde blev installeret for at fremskynde bevægelsen af elektroner, hvilket medførte en potentiel forskel.
- Strømmen af elektronstrålen blev rettet mod en metallisk krystal; i dette tilfælde nikkel.
- Antallet af elektroner, der påvirket nikkelkrystallen, blev målt.
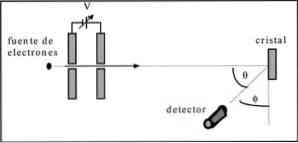
I slutningen af eksperimentet opdagede Davisson og Germer, at elektronerne blev spredt i forskellige retninger.
Ved at gentage eksperimentet ved hjælp af metalkrystaller med forskellige orienteringer, opdagede forskerne følgende:
- Dispersionen af elektronstrålen gennem metallisk krystal var sammenlignelig med fænomenet interferens og diffraktion af lysstrålerne.
- Refleksion af elektroner på virkningen glas beskrevet den sti, der teoretisk skulle beskrive teorien om elektron de Broglie bølger.
I syntesen viste eksperimentet af Davisson og Germer eksperimentelt den elektroniske dobbeltbølge-partikel-natur.
begrænsninger
Broglie-atommodellen forudsiger ikke den elektroniske placering af elektronen på banen, hvor den bevæger sig.
I denne model opfattes elektroner som bølger, der bevæger sig rundt om kredsløbet uden en bestemt placering, der introducerer begrebet elektronisk kredsløb.
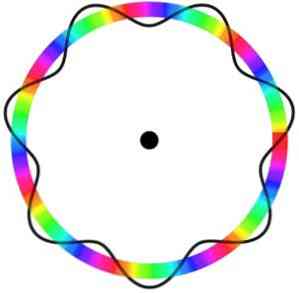
Derudover betragter Broglie-atommodellen, som er analog med Schrödinger-modellen, ikke-rotationen af elektroner på sin akse (spin-).
Ved at undgå den iboende impulsmoment af elektroner, er de forsømme de rumlige variationer af disse subatomare partikler.
I den samme rækkefølge af ideer tager denne model ikke hensyn til ændringer i hurtige elektroners opførsel som følge af relativistiske virkninger.
Artikler af interesse
Atom model af Schrödinger.
Atom model af Chadwick.
Atommodel af Heisenberg.
Atomisk model af Perrin.
Atommodel af Thomson.
Atommodel af Dalton.
Atomisk model af Dirac Jordan.
Atomisk model af Democritus.
Atom model af Bohr.
referencer
- Bohrs Quantum Theory og De Broglie Waves (s.f.). Hentet fra: ne.phys.kyushu-u.ac.j
- Louis de Broglie - Biografisk (1929). © Nobelfondet. Hentet fra: nobelprize.org
- Louis-Victor de Broglie (s.f.). Hentet fra: chemed.chem.purdue.edu
- Lovett, B. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Hentet fra: britannica.com
- Atomisk model af De Broglie. National University of Distance Education. Spanien. Hentet fra: ocw.innova.uned.es
- Waves of Matter af Louis De Broglie (s.f.). Hentet fra: hiru.eus
- Von Pamel, O., og Marchisio, S. (s.f.). Kvantemekanik National University of Rosario. Hentet fra: fceia.unr.edu.ar


