Carbon i naturen hvor den er fundet og hvordan, egenskaber, anvendelser
den kulstof i naturen Det kan findes i diamanter, olie og graffiti, blandt mange andre scenarier. Dette kemiske element indtager det sjette sted i det periodiske bord og er placeret i den vandrette række eller periode 2 og kolonne 14. Det er ikke-metallisk og tetravalent; Det vil sige, at du kan etablere 4 kemiske bindinger af delte elektroner eller kovalente bindinger.
Carbon er elementet med den største overflod i jordskorpen. Denne overflod, dens unikke mangfoldighed i dannelsen af organiske forbindelser og dets ekstraordinære evne til at danne makromolekyler eller polymerer ved de temperaturer, der almindeligvis findes på Jorden, gør det til at tjene som et fælles element i alle kendte livsformer.

Carbon eksisterer i naturen som et kemisk element uden at kombinere i form af grafit og diamant. Imidlertid kombineres det for det meste for at danne kemiske carbonforbindelser, såsom calciumcarbonat (CaCO).3) og andre forbindelser i olie og naturgas.
Det danner også flere mineraler såsom antracit, kul, brunkul og tørv. Den største betydning af kulstof er, at den udgør den såkaldte "byggesten af livet" og er til stede i alle levende organismer.
indeks
- 1 Hvor er kulstof fundet og i hvilken form?
- 1.1 Krystalformer
- 1.2 Amorfe former
- 1.3 Olie, naturgas og bitumen
- 2 Fysiske og kemiske egenskaber
- 2.1 Kemisk symbol
- 2.2 atomnummer
- 2.3 Fysisk tilstand
- 2,4 farve
- 2,5 atommasse
- 2.6 Smeltepunkt
- 2,7 kogepunkt
- 2,8 tæthed
- 2,9 Opløselighed
- 2.10 Elektronisk konfiguration
- 2.11 Antal elektroner i yder- eller valenslaget
- 2.12 Linkkapacitet
- 2,13 Catenación
- 3 Biogeokemisk cyklus
- 3.1 Fotosyntese
- 3.2 Åndedræt og nedbrydning
- 3.3 Geologiske processer
- 3.4 Interferens af menneskelig aktivitet
- 4 anvendelser
- 4.1 Olie og naturgas
- 4.2 grafit
- 4.3 Diamant
- 4.4 Antracit
- 4.5 Stenkul
- 4.6 Brunkul
- 4.7 tørv
- 5 referencer
Hvor er kulstof fundet og i hvilken form?
Ud over at være den kemiske komponent, der er fælles for alle former for liv, er kulstof i naturen til stede i tre krystallinske former: diamant, grafit og fulleren.
Der er også flere amorfe mineralske former for kul (antracit, brunkul, kul, tørv), flydende former (sorter af olier) og sodavand (naturgas).
Krystalformer
I de krystallinske former tilslutter carbonatomer danner bestilte mønstre med geometrisk rumlig indretning.
grafit
Det er et blødt stof af sort farve med glans eller metallisk glans og varmebestandig (ildfast). Dens krystallinske struktur præsenterer kulstofatomer forbundet i sekskantede ringe, som igen tilslutter sammen dannende ark.
Grafitaflejringer er knappe og er blevet fundet i Kina, Indien, Brasilien, Nordkorea og Canada.
diamant
Det er et meget hårdt faststof, transparent til lysets passage og meget tættere end grafit: værdien af diamantens tæthed svarer til næsten dobbelt så stor som grafit.
Kulatomerne i diamanten deltager i tetrahedral geometri. Ligeledes er diamanten dannet af grafit underkastet betingelser med meget høje temperaturer og tryk (3000 °C og 100 000 atm).
De fleste diamanter ligger mellem 140 og 190 km dybt i mantlen. Gennem dybe vulkanudbrud kan magma transportere dem til afstande tæt på overfladen.
Der er diamant indskud i Afrika (Namibia, Ghana, Den Demokratiske Republik Congo, Sierra Leone og Sydafrika), Amerika (Brasilien, Colombia, Venezuela, Guyana, Peru), Oceanien (Australien) og Asien (Indien).

fullerener
De er molekylære former for kulstof, der danner klynger på 60 og 70 carbonatomer i næsten sfæriske molekyler, svarende til fodboldkugler.
Der er også fullerener mindre end 20 carbonatomer. Nogle former for fullerener omfatter carbon nanorør og carbonfibre.

Amorfe former
I amorfe former forener ikke carbonatomerne, som udgør en ordnet og regelmæssig krystallinsk struktur. I stedet indeholder de endda urenheder fra andre elementer.
antracit
Det er den ældste kul metamorfe (som kommer fra klipper modificerende virkninger af temperatur, tryk eller kemisk indvirkning af væsker) siden dens dannelse går tilbage til den primære eller palæozoikum, Kultiden.
Antracit er den amorfe form for kulstof, der har et højere indhold af dette element: mellem 86 og 95%. Det er grå-sort og metallisk glans, og den er tung og kompakt.
Generelt findes antracit i områder med geologisk deformation og udgør ca. 1% af verdens kulreserver.
Geografisk findes den i Canada, USA, Sydafrika, Frankrig, Storbritannien, Tyskland, Rusland, Kina, Australien og Colombia.

Stenkul
Det er et mineralsk kul, sedimentær rock af organisk oprindelse, hvis dannelse stammer fra de paleozoiske og mesozoiske eraser. Det har et kulstofindhold på mellem 75 og 85%.
Det er sort, det er karakteriseret ved at være uigennemsigtigt og har et mat og fedtet udseende, da det har et højt indhold af bituminøse stoffer. Det er dannet ved kompression af brunkul i den paleozoiske æra i karbon og perioder.
Det er den mest rigelige form for kul på planeten. Der er store kulforekomster i USA, Storbritannien, Tyskland, Rusland og Kina.
brunkul
Det er et fossilt mineralsk kul dannet i tertiær alder fra tørv ved kompression (højtryk). Det har et lavere kulstofindhold end kul, mellem 70 og 80%.
Det er et lille kompakt materiale, smuldrende (karakteristisk, der adskiller det fra andre kulstofmineraler), brun eller sort. Dens konsistens svarer til træ og dets kulstofindhold varierer fra 60 til 75%.
Det er et let brændsel med lavt brændværdi og lavere vandindhold end tørv.
Der er vigtige brunkulminer i Tyskland, Rusland, Tjekkiet, Italien (Veneto, Toscana, Umbrien) og Sardinien. I Spanien er brunkullejrene i Asturien, Andorra, Zaragoza og La Coruña.
tørv
Det er et materiale af organisk oprindelse, hvis dannelse kommer fra den kvaternære æra, langt nyere end den tidligere kul.
Det er en brunlig gul farve og fremstår som en svampemasse med lav densitet, hvor du kan se plantesteder fra det sted, hvor den stammer fra.
I modsætning til den førnævnte kul, er tørv ikke fra carboniseringscykler processer træmateriale eller træ, men hovedsagelig dannet ved ophobning af planter og urter i sumpområder musgos- gennem en forkoksning proces er ikke afsluttet.
Torv har et højt vandindhold; Af denne grund kræver det tørring og komprimering før brug.
Den har et lavt kulstofindhold (kun 55%); Derfor har den en lav energiværdi. Når den udsættes for forbrænding, er dens aske rest rigelig og udsender meget røg.
Der er vigtige torvaflejringer i Chile, Argentina (Tierra del Fuego), Spanien (Espinosa de Cerrato, Palencia), Tyskland, Danmark, Holland, Rusland, Frankrig.

Olie, naturgas og bitumen
Olie (fra latin Petrae, hvilket betyder "sten"; og oleum, som betyder "olie": "rockolie") er en blanding af mange organiske forbindelser - de fleste carbonhydrider - produceret ved den anaerobe bakterielle nedbrydning (i mangel af ilt) af organisk materiale.
Det dannede sig i undergrunden på store dybder og under særlige forhold både fysiske (høje tryk og temperaturer) og kemiske (tilstedeværelse af specifikke katalysatorforbindelser) i en proces der tog millioner af år.
Under denne proces frigøres C og H af organiske væv og forbundet igen rekombination til dannelse af et utal af carbonhydrider blandes overensstemmelse med deres egenskaber og danner naturgas, olie og bitumen.
Jordens oliefelter er hovedsagelig placeret i Venezuela, Saudi Arabien, Irak, Iran, Kuwait, De Forenede Arabiske Emirater, Rusland, Libyen, Nigeria og Canada.
Der er naturgasreserver i Rusland, Iran, Venezuela, Qatar, USA, Saudi Arabien og De Forenede Arabiske Emirater, blandt andre.
Fysiske og kemiske egenskaber
Blandt kulstofegenskaberne kan vi nævne følgende:
Kemisk symbol
C.
Atomnummer
6.
Fysisk tilstand
Fast, under normale betingelser for tryk og temperatur (1 atmosfære og 25 °C).
farve
Grå (grafit) og gennemsigtig (diamant).
Atommasse
12.011 g / mol.
Smeltepunkt
500 °C.
Kogepunkt
827 °C.
tæthed
2,62 g / cm3.
opløselighed
Uopløseligt i vand, opløseligt i CCl tetrachlorid4.
Elektronisk konfiguration
1s2 2s2 2p2.
Antal elektroner i det ydre lag eller valens
4.
Link kapacitet
4.
kædedannelsen
Det har evnen til at danne kemiske forbindelser i lange kæder.
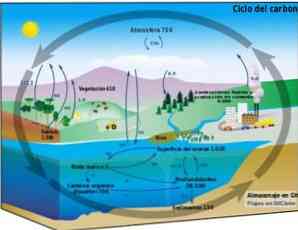
Biogeokemisk cyklus
Carboncyklussen er en cirkulær biogeokemisk proces, gennem hvilken kulstof kan udveksles mellem biosfæren, atmosfæren, hydrokfæren og den jordbaserede litosfære.
Kendskabet til denne cykliske carbonproces på Jorden gør det muligt at demonstrere menneskelig handling på denne cyklus og dens konsekvenser for globale klimaændringer.
Carbon kan cirkulere mellem oceaner og andre vandkilder såvel som mellem litosfæren, i jord og undergrunden, i atmosfæren og i biosfæren. I atmosfæren og hydrokfæren eksisterer kulstof i gasform som CO2 (kuldioxid).
fotosyntese
Kul i atmosfæren er fanget af de jordbaserede og akvatiske organismer i økosystemerne (fotosyntetiske organismer).
Fotosyntese tillader en kemisk reaktion mellem CO at forekomme2 og vand, medieret af solenergi og klorofyl fra planter, for at producere kulhydrater eller sukkerarter. Denne proces transformerer simple molekyler med lavt CO-energiindhold2, H2O og oxygen O2, i komplekse molekylære former for høj energi, som er sukkerarter.
De heterotrofe organismer - der ikke kan udføre fotosyntesen og det er forbrugerne i økosystemerne - få kulstof og energi, når de fodrer sig med producenterne og andre forbrugere.
Vejrtrækning og nedbrydning
Åndedræt og nedbrydning er biologiske processer, der frigiver kulstof til miljøet i form af CO2 eller CH4 (methan produceret i den anaerobe nedbrydning, det vil sige i mangel af ilt).
Geologiske processer
Ved geologisk og som et resultat af processer over tid, kan den anaerobe nedbrydning af carbon omdannes til fossile brændsler som olie, naturgas og kul. Ligeledes er kulstof også en del af andre mineraler og klipper.
Interferens af menneskelig aktivitet
Når man bruger brændingen af fossile brændstoffer til energi, vender kulet tilbage til atmosfæren i form af enorme mængder CO2 som ikke kan ligestilles med den naturlige biogeokemiske cyklus af kulstof.
Dette overskydende CO2 produceret af menneskelig aktivitet påvirker balancen af kulstofcyklussen negativt og er hovedårsagen til global opvarmning.
applikationer
Anvendelsen af kulstof og dens forbindelser er ekstremt varieret. Den mest fremragende med følgende:
Olie og naturgas
Den vigtigste økonomiske anvendelse af kulstof er repræsenteret ved anvendelse som et fossilt brændselskulstof, såsom metangas og råolie..
Olien destilleres i raffinaderier at opnå flere derivater, såsom benzin, diesel, petroleum, asfalt, smøremidler, opløsningsmidler og andre, som igen anvendes i den petrokemiske industri fremstilling af råmaterialer til de plast, gødning, lægemidler og maling , blandt andre.
grafit
Graphite bruges i følgende handlinger:
- Det bruges til fremstilling af blyanter, blandet med ler.
- Det er en del af fremstillingen af ildfaste mursten og kryds, varmebestandige.
- I forskellige mekaniske anordninger såsom skiver, lejer, stempler og pakninger.
- Det er et fremragende solidt smøremiddel.
- På grund af dets elektriske ledningsevne og dets kemiske inertitet anvendes den til fremstilling af elektroder, elektriske motorkuler.
- Det bruges som moderator i atomkraftværker.
diamant
Diamanten har specielt ekstraordinære fysiske egenskaber, såsom den højere grad af hårdhed og termisk ledningsevne, der indtil nu er kendt.
Disse funktioner tillader industrielle anvendelser i værktøjer, der bruges til at lave skære- og poleringsinstrumenter til deres høje abrasivitet.
Optiske egenskaber såsom gennemsigtighed og evnen til at bryde hvidt lys og bryder lys- giver mange applikationer i optiske instrumenter, og fremstilling af linser og prismer.
Den karakteristiske lysstyrke afledt af dens optiske egenskaber er også meget værdsat i smykker industrien.
antracit
Antracit har svært ved at antænde, er langsomt brændende og kræver meget ilt. Dets forbrænding producerer lille flame af lyseblå farve og udledning af meget varme.
For nogle år siden blev antracit brugt i termoelektriske planter og til husholdning. Dens anvendelse har fordele som produktion af lille aske eller støv, lille røg og en langsom forbrændingsproces.
På grund af den høje økonomiske pris og mangel er antracit blevet erstattet af naturgas i termoelektriske anlæg og ved elkraft i boliger.
Stenkul
Kul anvendes som råmateriale til opnåelse af:
- Koks, brændstof fra højovne i stålværker.
- Creosot, opnået ved blanding af tjære destillater fra stenkul og anvendt som beskyttende fugemasse til træ udsat for vejret.
- Cresol (kemisk methylphenol) ekstraheret fra kul og anvendes som et desinfektionsmiddel og antiseptisk middel,
- Andre derivater, såsom gas, tjære eller beg, og forbindelser anvendes til fremstilling af parfumer, insekticider, plast, belægninger, dæk og vejoverflader osv.
brunkul
Brunkul repræsenterer et brændstof af mellemkvalitet. Strålen, sorten af brunkul, er kendetegnet ved at være meget kompakt ved den lange proces af karbonisering og højt tryk, og bruges i smykker og udsmykning.
tørv
Torv bruges i følgende aktiviteter;
- Til vækst, støtte og transport af plantearter.
- Som en organisk gødning.
- Som en seng af dyr i stalde.
- Som brændstof af lav kvalitet.
referencer
- Burrows, A., Holman, J., Parsons, A., Pilling, G. og Price, G. (2017). Kemi3: Introduktion af uorganisk, organisk og fysisk kemi. Oxford University Press.
- Deming, A. (2010). Konge af elementerne? Nanoteknologi. 21 (30): 300201. doi: 10.1088
- Dienwiebel, M., Verhoeven, G., Pradeep, N., Frenken, J., Heimberg, J. og Zandbergen, H. (2004). Superlubricitet af grafit. Fysiske Review Letters. 92 (12): 126101. doi: 10.1103
- Irifune, T., Kurio, A., Sakamoto, S., Inoue, T. og Sumiya, H. (2003). Materialer: Ultrahard polykrystallinsk diamant fra grafit. Naturen. 421 (6923): 599-600. doi: 10,1038
- Savvatimskiy, A. (2005). Målinger af smeltepunktet af grafit og egenskaberne af flydende kulstof (en gennemgang for 1963-2003). Carbon. 43 (6): 1115. doi: 10,1016


