Balancering af kemiske ligningsmetoder og eksempler
den afvejning af kemiske ligninger indebærer, at alle de elementer, der er til stede i ligningen, har samme antal atomer på hver side. For at opnå dette er det nødvendigt at anvende balanceringsmetoderne til at tildele de støkiometriske koefficienter, der er egnede til hver art, der er til stede i reaktionen.
En kemisk ligning er repræsentationen ved hjælp af symboler af hvad der sker i løbet af en kemisk reaktion mellem to eller flere stoffer. Reaktanterne interagerer med hinanden, og afhængigt af reaktionsbetingelserne opnås en eller flere forskellige forbindelser som et produkt..
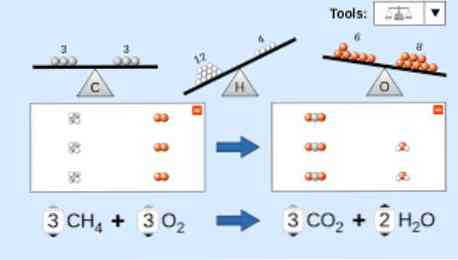
Ved beskrivelse af en kemisk ligning skal der tages hensyn til følgende: For det første skrives reaktantstofferne på venstre side af ligningen efterfulgt af en ensrettet pil eller to modsatte vandrette pile afhængigt af den type reaktion, der udføres. kappe.
indeks
- 1 Metoder til afbalancering af kemiske ligninger
- 1.1 Balance af kemiske ligninger ved forsøg og fejl (kaldes også ved inspektion eller prøve)
- 1.2 Algebraisk afbalancering af kemiske ligninger
- 1.3 Rolling af redox ligninger (ion-elektron metode)
- 2 Eksempler på at afbalancere kemiske ligninger
- 2.1 Første eksempel
- 2.2 Andet eksempel
- 2.3 Tredje eksempel
- 3 referencer
Balanceringsmetoder for kemiske ligninger
På baggrund af at reaktanterne og produkterne er kendt, og at deres formler er korrekt udtrykt på den side, der svarer til dem, fortsætter vi med at afbalancere ligningerne i overensstemmelse med følgende metoder.
Balancering af kemiske ligninger ved forsøg og fejl (kaldes også ved inspektion eller prøve)
Den er baseret på reaktionens støkiometri og forsøger at forsøge med forskellige koefficienter for at balancere ligningen, så længe det mindste mulige heltal vælges, hvormed det samme antal atomer af hvert element opnås på begge sider af reaktionen.
Koefficienten af en reaktant eller et produkt er det antal forud for formel, og er det eneste tal, der kan ændres, når den afvejning ligning udføres, eftersom hvis indekserne med formlen skiftes ville være at ændre identiteten af forbindelsen i spørgsmålet.
Tæl og sammenlign
Efter at have identificeret hvert element af reaktionen og placerer det på den rigtige side, fortsætter vi med at tælle og sammenligne antallet af atomer af hvert element, der er til stede i ligningen, og bestemme dem, der skal afbalanceres.
Så fortsætter vi med balanceringen af hvert element (en ad gangen) ved at placere hele koefficienter forud for hver formel, der indeholder ubalancerede elementer. Normalt er de metalliske elementer afbalanceret først, derefter de ikke-metalliske elementer og til sidst ilt- og hydrogenatomerne.
På denne måde multiplicerer hver koefficient alle atomerne i den foregående formel; så mens man balancerer et element, kan de andre ubalancere, men dette korrigeres, da reaktionen er afbalanceret.
Endelig bekræftes det af et sidste tal, at hele ligningen er korrekt afbalanceret, det vil sige at den overholder loven om bevaring af materie.
Algebraisk afbalancering af kemiske ligninger
For at bruge denne fremgangsmåde tilvejebringer en fremgangsmåde til behandling koefficienter ligninger som ubekendte kemisk system, der skal løses.
For det første tages et specifikt element af reaktionen som reference, og koefficienterne placeres som bogstaver (a, b, c, d ...), som repræsenterer de ukendte, ifølge de eksisterende atomer af det pågældende element i hvert molekyle (hvis en art indeholder ikke, at elementet er placeret "0").
Efter opnåelse af denne første ligning bestemmes ligningerne for de andre elementer, som er til stede i reaktionen; der vil være lige så mange ligninger, som der er elementer i reaktionen.
Endelig bestemmes de ukendte af en af de algebraiske metoder til reduktion, udligning eller substitution, og koefficienterne opnås, der resulterer i den korrekt afbalancerede ligning.
Balancering af redox-ligninger (ion-elektronmetode)
Først placeres den generelle (ubalancerede) reaktion i sin ioniske form. Derefter er denne ligning opdelt i to halvreaktioner, oxidationen og reduktionen, hver afbalancering i overensstemmelse med antallet af atomer, deres type og ladningerne af disse.
For eksempel, for de reaktioner, der forekommer i surt medium, tilsættes H molekyler.2Eller for at afbalancere iltatomer og tilføje H+ at afbalancere hydrogenatomerne.
I modsætning hertil tilsættes i et alkalisk medium et lige antal OH-ioner- på de to sider af ligningen for hver H ion+, og hvor H ioner opstår+ og OH- de kommer sammen til at danne H molekyler2O.
Tilføj elektroner
Derefter skal du tilføje så mange elektroner som nødvendigt for at afbalancere ladningerne, efter at balancere sagen i hver halvreaktion.
Efter rullingen af hver halvreaktion tilsættes disse og kulmineres ved at balancere den endelige ligning ved forsøg og fejl. Hvis der er en forskel i antallet af elektroner af de to halvreaktioner, skal en eller begge gange ganges med en koefficient svarende til dette tal.
Endelig skal det bekræftes, at ligningen indbefatter det samme antal atomer og samme type atomer, ud over at have de samme ladninger på begge sider af den globale ligning.
Eksempler på at afbalancere kemiske ligninger
Første eksempel
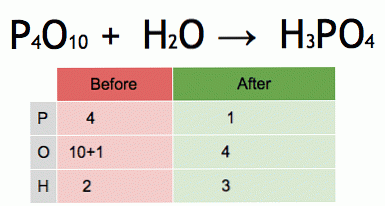
Dette er en animation af en afbalanceret kemisk ligning. Fosforpentoxid og vand omdannes til phosphorsyre.
P4O10 + 6 H20 → 4 H3PO4 (-177 kJ).
Andet eksempel
Du har forbrændingsreaktionen af etan (ubalanceret).
C2H6 + O2 → CO2 + H2O
Ved at anvende metoden for forsøg og fejl for at afbalancere det bemærkes det, at ingen af elementerne har det samme antal atomer på begge sider af ligningen. Således begynder det med kulstofbalancen og tilføjer en to som en støkiometrisk koefficient, som ledsager den på siden af produkterne.
C2H6 + O2 → 2CO2 + H2O
Carbon er afbalanceret på begge sider, så vi fortsætter med at afbalancere brintet ved at tilføje en tre til vandmolekylet.
C2H6 + O2 → 2CO2 + 3H2O
Endelig, da der er syv oxygenatomer på højre side af ligningen, og det er det sidste element, som stadig skal afbalanceres, placeres det fraktionelle nummer 7/2 foran oxygenmolekylet (selv om hele koefficienter generelt foretrækkes).
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Kontroller derefter, at der på hver side af ligningen er det samme antal carbonatomer (2), hydrogen (6) og oxygen (7).
Tredje eksempel
Oxidationen af jern med dichromationer forekommer i et surt medium (ubalanceret og i dets ioniske form).
tro2+ + Cr2O72- → Tro3+ + Cr3+
Ved anvendelse af ion-elektronmetoden til dens afbalancering er den opdelt i to halvreaktioner.
Oxidering: Tro2+ → Tro3+
Reduktion: Cr2O72- → Cr3+
Da jernatomerne allerede er afbalanceret (1: 1), tilsættes en elektron på siden af produkterne for at afbalancere ladningen.
tro2+ → Tro3+ + og-
Nu er atomerne af Cr afbalanceret og tilføjer en to til højre for ligningen. Så når reaktionen finder sted i surt medium, tilsættes syv H molekyler.2Eller på siden af produkterne for at afbalancere iltatomer.
Cr2O72- → 2Cr3+ + 7H2O
For at afbalancere H-atomer er der tilsat fjorten H-ioner+ på siden af reaktanterne og efter udligning af materialet afbalanceres ladningerne ved tilsætning af seks elektroner på samme side.
Cr2O72- +14H+ + 6e- → 2Cr3+ + 7H2O
Endelig tilsættes begge halvreaktioner, men da der kun er en elektron i oxidationsreaktionen, skal alt dette multipliceres med seks.
6FE2+ + Cr2O72- +14H+ + 6e- → Tro3+ + 2Ch3+ + 7H2O + 6e-
Endelig skal elektronerne elimineres på begge sider af den globale ioniske ligning og verificere, at deres ladning og materiel er korrekt afbalanceret.
referencer
- Chang, R. (2007). Kemi. (9. udgave). McGraw-Hill.
- Hein, M. og Arena, S. (2010). Grundlag for College Chemistry, alternativ. Hentet fra books.google.co.ve
- Tuli, G. D. og Soni, P. L. (2016). Kemisk sprog eller kemiske ligninger. Hentet fra books.google.co.ve
- Hurtig udgivelse (2015). Kemi sammenligninger og svar (Speedy Study Guides). Hentet fra books.google.co.ve


