Kalkbicarbonatstruktur, egenskaber, risici og anvendelser
den calciumbicarbonat er et uorganisk salt med kemisk formel Ca (HCO)3)2. Den stammer naturligt fra det calciumcarbonat, der findes i kalkstensklipper og mineraler som calcit.
Calciumbicarbonat er mere opløseligt i vand end calciumcarbonat. Denne karakteristik har muliggjort dannelsen af karst-systemer i kalkstensklipper og i strukturering af huler.

Det underjordiske vand, der passerer gennem revnerne, bliver mættet ved deres forskydning af kuldioxid (CO2). Disse farvande eroderer kalkstenstenene, der frigiver calciumcarbonat (CaCO3), der vil danne calciumbicarbonatet ifølge den følgende reaktion:
CaCO3(r) + CO2(g) + H2O (1) => Ca (HCO)3)2(Aq)
Denne reaktion forekommer i huler, hvor meget hårdt vand stammer fra. Calciumbicarbonat findes ikke i fast tilstand, men i en vandig opløsning sammen med Ca2+, bicarbonatet (HCO)3-) og carbonationen (CO32-).
Efterfølgende, når mætningen af kuldioxid i vandet falder, finder den omvendte reaktion sted, dvs. omdannelsen af calciumhydrogencarbonatet til calciumcarbonat:
Ca (HCO)3)2(aq) => CO2 (g) + H2O (1) + CaCO3 (S)
Calciumcarbonat er dårligt opløseligt i vand, hvilket medfører, at dens udfældning forekommer som et faststof. Ovennævnte reaktion er meget vigtig i dannelsen af stalaktitter, stalagmitter og andre speleothemer i huler.
Disse stenrige strukturer er dannet af de dråber vand, der falder fra hulernes hul (topbillede). CaCO3 Til stede i dråberne vand krystalliseres til dannelse af de nævnte strukturer.
Den kendsgerning, at calciumhydrogencarbonat ikke findes i fast tilstand, har gjort brugen vanskelig, og få eksempler findes. Det er også svært at finde oplysninger om dets toksiske virkninger. Der er en rapport om et sæt bivirkninger af dets anvendelse som en behandling for at forhindre osteoporose.
struktur
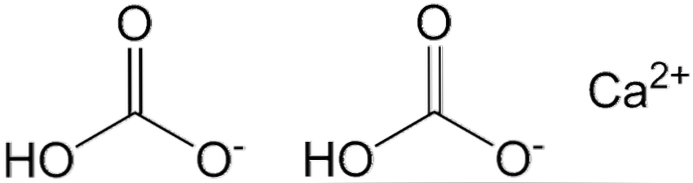
To HCO anioner vises i det øverste billede3- og en Ca-kation2+ interagerer elektrostatisk. Ca2+ ifølge billedet skal det være placeret i midten, da det er hvordan HCO'erne3- de ville ikke afvise hinanden på grund af deres negative afgifter.
Den negative ladning i HCO3- det er delokaliseret mellem to oxygenatomer ved resonans mellem C = O carbonylgruppen og C-O-bindingen-; mens i CO32-, Dette er delokaliseret mellem de tre oxygenatomer, da C-OH-bindingen er deprotoneret og derfor kan modtage en negativ ladning ved resonans.
Geometrierne af disse ioner kan betragtes som kugler af calcium omgivet af flade trekanter af carbonater med en hydrogeneret ende. Med hensyn til størrelsesforhold er calcium væsentligt mindre end HCO-ioner3-.
Vandige opløsninger
Ca (HCO)3)2 Det kan ikke danne krystallinske faste stoffer, og det består virkelig af vandige opløsninger af dette salt. I dem er ionerne ikke alene, som i billedet, men omgivet af H-molekyler.2O.
Hvordan interagerer de? Hver ion er omgivet af en hydratiseringssfære, som afhænger af metallets, polariteten og strukturen af de opløste arter.
Ca2+ koordinater med oxygenatomer af vand til dannelse af en aquokompleks, Ca (OH)2)n2+, hvor n generelt anses for at være seks; det vil sige en "vandig oktaedron" omkring calcium.
Mens HCO anioner3- interagere med enten hydrogenbindinger (OR2CO-H-OH2) eller med hydrogenatomerne i vandet i retning af de negative ladningsdelokaliseringer (HOCO)2- H-OH, dipoleion-interaktion).
Disse vekselvirkninger mellem Ca2+, HCO3- og vandet er så effektivt, at de gør calciumbicarbonatet meget opløseligt i dette opløsningsmiddel; i modsætning til CaCO3, hvor de elektrostatiske attraktioner mellem Ca2+ og CO32- er meget stærke, udfældning fra den vandige opløsning.
Udover vand er der CO molekyler2 rundt, som reagerer langsomt for at give mere HCO3- (afhængigt af pH-værdierne).
Hypotetisk faststof
Hidtil har størrelsen og ladningerne af ionerne i Ca (HCO)3)2, eller tilstedeværelsen af vand, forklare hvorfor den faste forbindelse ikke eksisterer; det vil sige rene krystaller, som kan karakteriseres ved røntgenkrystallografi. Ca (HCO)3)2 er intet mere end ioner til stede i vandet, hvorfra de hulformede formationer fortsætter med at vokse.
Ja Ca2+ og HCO3- de kunne isoleres fra vandet og undgår følgende kemiske reaktion:
Ca (HCO)3)2(aq) → CaCO3(r) + CO2(g) + H2O (l)
Derefter kunne disse grupperes i et hvidt krystallinsk faststof med støkiometriske proportioner 2: 1 (2HCO3/ 1Ca). Der er ingen undersøgelser af dets struktur, men det kan sammenlignes med NaHCO3 (for magnesiumbicarbonat, Mg (HCO)3)2, hverken findes som fast) eller med CaCO3.
Stabilitet: NaHCO3 vs Ca (HCO)3)2
NaHCO3 krystalliserer i det monokliniske system og CaCO3 i de trigonale (calcit) og orthorhombiske (aragonit) systemer. Hvis Na blev udskiftet+ til Ca2+, Det krystallinske netværk ville blive destabiliseret af den større forskel i størrelser; det vil sige na+ fordi det er mindre, danner det en mere stabil krystal med HCO3- i forhold til Ca2+.
Faktisk er Ca (HCO)3)2(aq) har vandet til at fordampe, så dets ioner kan grupperes i en krystal; men denne krystal gitter er ikke stærk nok til at gøre det ved stuetemperatur. Når vandet opvarmes, forekommer dekomponeringsreaktionen (ligning ovenfor).
At være Na ion+ i opløsning ville dette danne krystal med HCO3- før dens termiske nedbrydning.
Grunden til hvorfor Ca (HCO)3)2 det krystalliserer ikke (teoretisk), det er ved forskellene af ioniske radier eller størrelser af dets ioner, som ikke kan danne en stabil krystal før dens nedbrydning.
Ca (HCO)3)2 vs CaCO3
Hvis derimod H blev tilsat+ til de krystallinske strukturer af CaCO3, de ville ændre deres fysiske egenskaber drastisk. Måske falder dens smeltepunkter markant, og endog ændres krystallernes morfologier modificeret.
Ville det være værd at prøve syntesen af Ca (HCO)3)2 Solid? Vanskeligheder kan overstige forventninger, og et salt med lav strukturel stabilitet kan ikke give betydelige yderligere fordele ved enhver anvendelse, hvor andre salte allerede er anvendt.
Fysiske og kemiske egenskaber
Kemisk formel
Ca (HCO)3)2
Molekylvægt
162,11 g / mol
Fysisk tilstand
Det vises ikke i fast tilstand. Det findes i vandig opløsning, og forsøg på at omdanne det til faststof ved fordampning af vand, har ikke fungeret som det omdannes til calciumcarbonat.
Opløselighed i vand
16,1 g / 100 ml ved 0 ° C; 16,6 g / 100 ml ved 20 ° C og 18,4 g / 100 ml ved 100 ° C. Disse værdier er indicative for en høj affinitet af vandmolekyler for Ca-ioner (HCO)3)2, som forklaret i det foregående afsnit. I mellemtiden er kun 15 mg CaCO3 de opløses i en liter vand, hvilket afspejler deres stærke elektrostatiske interaktioner.
Fordi Ca (HCO)3)2 det kan ikke danne et fast stof, dets opløselighed kan ikke bestemmes eksperimentelt. Men i betragtning af de betingelser, der er skabt af CO2 opløst i vandet omkring kalkstenen, kunne massen af calcium opløst ved en temperatur T beregnes; masse, hvilket ville være lig med koncentrationen af Ca (HCO)3)2.
Ved forskellige temperaturer øges den opløste masse som vist ved værdierne ved 0, 20 og 100 ° C. Så ifølge disse forsøg, hvor meget af Ca (HCO) bestemmes3)2 opløses i nærheden af CaCO3 i et vandigt medium gasificeret med CO2. Når CO flyder2 gasformig, CaCO3 vil udfælde, men ikke Ca (HCO3)2.
Fusion og kogepunkt
Det krystallinske netværk af Ca (HCO)3)2 er meget svagere end CaCO3. Hvis det kan opnås i en fast tilstand, og måle temperaturen, hvor den smelter inde i et fusiometer, ville det sikkert få en værdi langt under 899ºC. Ligeledes kan det samme forventes ved bestemmelsen af kogepunktet.
Forbrændingssted
Det er ikke brændbart.
risici
Da denne forbindelse ikke eksisterer i fast form, er det usandsynligt, at det ville udgøre en risiko for at manipulere dets vandige opløsninger, da både Ca2+ som HCO3- de er ikke skadelige i lave koncentrationer; og derfor kan den største risiko for at indtage sådanne løsninger skyldes kun en farlig dosis af indtaget calcium.
Hvis forbindelsen dannede et faststof, selv om det kan være fysisk forskelligt fra CaCO3, dets toksiske virkninger må ikke gå ud over simpelt ubehag og resektioner efter fysisk kontakt eller indånding.
applikationer
-Calciumbicarbonat-opløsninger er blevet brugt i lang tid til at vaske gamle papirer, især kunstværker eller historisk vigtige dokumenter.
-Anvendelsen af bicarbonatopløsninger er nyttig, ikke kun fordi de neutraliserer syrerne i papiret, men også tilvejebringer en alkalisk reserve af calciumcarbonat. Denne sidste forbindelse giver beskyttelse til fremtidige skader på papir.
-Ligesom andre bicarbonater anvendes den i kemiske gær og i formuleringer af brusende tabletter eller pulvere. Derudover anvendes calciumbicarbonat som et fødevaretilsætningsstof (vandige opløsninger af dette salt).
-Bicarbonatopløsningerne er blevet anvendt til forebyggelse af osteoporose. Imidlertid er sekundære virkninger som hypercalcæmi, metabolisk alkalose og nyresvigt blevet observeret i ét tilfælde..
-Calciumbicarbonat indgives, lejlighedsvis intravenøst for at korrigere hypokalemis depressive virkning på hjertefunktionen.
-Og endelig giver det calcium til kroppen, som er en formidler af muskelkontraktion, samtidig med at den korrigerer den acidose, der kan forekomme i en hypokalæmi tilstand..
referencer
- Wikipedia. (2018). Calciumbicarbonat. Hentet fra: en.wikipedia.org
- Sirah Dubois. (3. oktober 2017). Hvad er calciumbicarbonat? Hentet fra: livestrong.com
- Science Learning Hub. (2018). Carbonatkemi. Hentet fra: sciencelearn.org.nz
- Pubchem. (2018). Calcium Bicarbonat. Hentet fra: pubchem.ncbi.nlm.nih.gov
- Amy E. Gerbracht & Irene Brückle. (1997). Anvendelsen af Calcium Bicarbonate og Magnesium Bicarbonate Solutions i Small Conservation Workshops: Undersøgelsesresultater. Hentet fra: cool.conservation-us.org


