Ketoner Typer, Egenskaber, Nomenklatur, Anvendelser og Eksempler
den ketoner de er organiske forbindelser, der har en carbonylgruppe (-CO). De er enkle forbindelser, hvori carbonylgruppen er bundet til to carbonatomer (og deres substituentkæder). Ketoner er "simple", fordi de ikke har reaktive grupper som -OH eller -Cl bundet til carbon.
Endelig er elimineringen af ketoner fra den menneskelige krop normalt forbundet med et lavt sukkerniveau (i diabetiske tilfælde og / eller ekstreme faste), hvilket kan forårsage alvorlige helbredsproblemer for patienten.
indeks
- 1 Generel formel af ketoner
- 2 Typer af ketoner
- 2.1 Ifølge strukturen i din kæde
- 2.2 Ifølge symmetrien af dets radikaler
- 2.3 Ifølge mætningen af dets radikaler
- 2.4 Dicetoner
- 3 Fysiske og kemiske egenskaber af ketoner
- 3.1 kogepunkt
- 3.2 Opløselighed
- 3.3 surhed
- 3.4 Reaktivitet
- 4 nomenklaturen
- 5 Forskel mellem aldehyder og ketoner
- 6 Industrielle og daglige anvendelser
- 7 Eksempler på ketoner
- 7,1 butanon (C4H8O)
- 7.2 Cyclohexanon (C6H10O)
- 7.3 Testosteron (C19H22O2)
- 7.4 Progesteron (C21H30O2)
- 8 referencer
Generel formel af ketoner
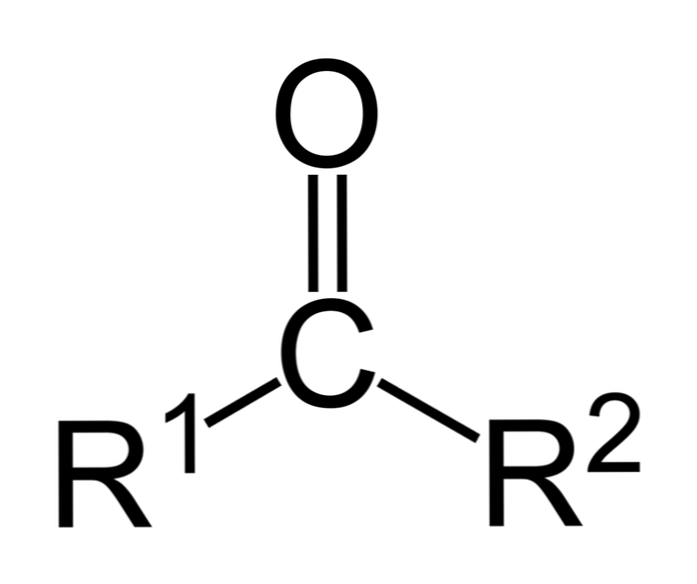
Ketoner er carbonylforbindelser, hvori denne gruppe er bundet til to carbonhydridgrupper; disse kan være alkylgrupper, benzenringgrupper eller begge dele.
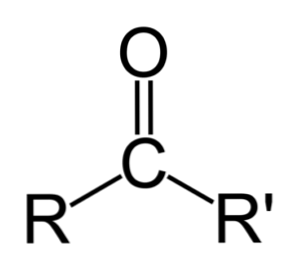
En keton kan repræsenteres simpelthen som R- (C = O) -R 'hvor R og R' er enten to carbonhydridkæder (alkaner, alkener, alkyner, cycloalkaner, benzen derivater og andre). Der er ingen ketoner med et hydrogen bundet til carbonylgruppen.
Der findes en lang række metoder til fremstilling af ketoner i industri- og laboratoriemiljøet; Derudover er det vigtigt at bemærke, at ketoner kan syntetiseres af forskellige organismer, herunder mennesker.
I industrien involverer den mest almindelige metode til syntese af ketoner oxidation af carbonhydrider, typisk ved brug af luft. I mindre skala fremstilles ketoner sædvanligvis gennem oxidation af sekundære alkoholer, der som produkter giver en keton og vand som produkter.
Ud over disse almindelige fremgangsmåder, kan ketonerne syntetiseres via alkener, alkyner, kvælstofforbindelser salte, estere og mange andre forbindelser, hvilket gør dem lette at opnå.
Typer af ketoner
Der er flere klassifikationer for ketoner, der hovedsagelig afhænger af substituenterne i deres kæder R. Følgende er de mest almindelige klassifikationer for disse stoffer:
Ifølge strukturen i din kæde
I dette tilfælde er ketonen klassificeret af den måde, hvorpå det er struktureret kæde: alifatiske ketoner er dem med to R og R 'grupper med alkylgrupper danner (alkaner, alkener, alkyner og cycloalkaner).
Aromatiske stoffer er for det meste dem, der danner benzenderivater, mens de stadig er ketoner. Endelig er blandede ketoner dem, der har et R-alkylradikal og et R 'arylradikal eller omvendt.
Ifølge symmetrien af dets radikaler
I dette tilfælde studeres radikalerne R og R 'substituenter af carbonylgruppen; når disse er ens (identiske) kaldes ketonen symmetrisk; men når de er forskellige (som de fleste ketoner), kaldes det asymmetrisk.
Ifølge mætningen af dets radikaler
Ketoner kan også klassificeres efter mættet af deres carbonkæder; Hvis disse er i form af alkaner, kaldes ketonen en mættet keton. I modsætning hertil, hvis kæderne findes som alkener eller alkyner, kaldes ketonen umættet keton.
diketoner
Dette er en separat klasse af keton, da kæderne i denne keton har to carbonylgrupper i deres struktur. Nogle af disse ketoner har unikke egenskaber, såsom en længere bindelængde mellem carbonatomer.
For eksempel er diketoner afledt af cyclohexan kendt som quinoner, som kun er to: ortho-benzoquinon og para-benzoquinon.
Fysiske og kemiske egenskaber af ketoner
Ketoner, som de fleste aldehyder, er flydende molekyler og har en række fysiske og kemiske egenskaber, der varierer afhængigt af længden af deres kæder. Dens egenskaber er beskrevet nedenfor:
Kogepunkt
Ketoner er meget flygtige, i det væsentlige polære og kan ikke donere hydrogen til hydrogenbindinger (ikke besidder hydrogenatomer bundet til carbonylgruppen), så at de nuværende punkter af højere alkener og ethere koger, men lavere end alkoholer med samme molekylvægt.
Kogepunktets kogepunkt øges, da molekylets størrelse øges. Dette skyldes indgreb fra van der Waals-styrkerne og dipol-dipolstyrkerne, som kræver en større mængde energi til at adskille atomerne og elektronerne tiltrukket af molekylet..
opløselighed
Opløseligheden af ketoner har en stærk indflydelse på en del af disse molekylers evne til at acceptere hydrogener i deres oxygenatom og danner således hydrogenbinding med vand. Derudover dannes attraktive, sprednings- og dipol-dipolkræfter mellem ketoner og vand, hvilket øger deres opløselige virkning.
Ketoner mister opløselighedskapaciteten jo større deres molekyle, da de begynder at kræve mere energi at opløses i vand. De er også opløselige i organiske forbindelser.
surhed
Takket være sin carbonylgruppe har ketoner en sur natur; dette sker på grund af resonansstabiliseringskapaciteten for denne funktionelle gruppe, som kan overføre protoner fra dets dobbeltbinding til dannelse af en konjugatbase kaldet enol.
reaktivitet
Ketoner er en del af et stort antal organiske reaktioner; dette sker på grund af modtagelsen af dets carbonylcarbon til den nukleofile tilsætning ud over polariteten heraf.
Som nævnt ovenfor gør den høje reaktivitet af ketoner dem et anerkendt mellemprodukt, der tjener som grundlag for syntetisering af andre forbindelser.
nomenklatur
Ketoner er navngivet efter den prioritet eller vigtighed af carbonylgruppen i hele molekylet, så når et molekyle er styret af carbonylgruppen ketonen navngives ved at tilføje endelsen "-on" navn carbonhydrid.
Den længste kæde med carbonylgruppen tages som hovedkæden, og så kaldes molekylet. Hvis carbonylgruppen ikke har prioritet over de andre funktionelle grupper i molekylet, identificeres den med "-oxo".
For mere komplicerede ketoner kan identificere positionen af den funktionelle gruppe med et tal, og i tilfælde af diketoner (ketoner med to substituenter R og 'identiske R), er molekylet navngivet med endelsen '-dion'.
Endelig kan ordet "keton" også anvendes efter identifikation af kæderne af radikaler bundet til den carbonylfunktionelle gruppe.
Forskel mellem aldehyder og ketoner
Den største forskel mellem aldehyder og ketoner er tilstedeværelsen af et hydrogenatom bundet til carbonylgruppen i aldehyderne.
Dette atom har en vigtig virkning, når det drejer sig om at involvere et molekyle i en oxidationsreaktion: et aldehyd vil danne en carboxylsyre eller et carboxylsyresalt afhængigt af om oxidation sker under sure eller basiske betingelser.
I modsætning hertil har et keton ikke dette hydrogen, så de mindste trin, der er nødvendige for oxidation, forekommer ikke.
Der er metoder til at oxidere et keton (med oxidationsmidler meget kraftigere end de der typisk anvendes), men disse bryder ketonmolekylet og adskiller det først i to eller flere dele.
Industrielle og daglige anvendelser
I branchen observeres ketoner ofte i parfume og maling, idet der tages roller af stabilisatorer og konserveringsmidler, der forhindrer andre komponenter i blandingen i at nedbrydes; de har også et bredt spektrum som opløsningsmidler i de industrier, der fremstiller sprængstoffer, maling og tekstiler, ud over lægemidler.
Aceton (det mindste og enkleste keton) er et opløsningsmiddel, der er anerkendt over hele verden, og bruges som en malingfjerner og tyndere.
I naturen kan ketoner fremstå som sukkerarter, kaldet ketoser. Ketoser er monosaccharider, der indeholder en keton pr. Molekyle. Den bedst kendte ketose er fructose, sukker findes i frugt og honning.
Den fedtsyrebiosyntese, som forekommer inden for cytoplasmaet af dyreceller, forekommer også gennem virkningen af ketoner. Endelig og som nævnt ovenfor kan der være en stigning af ketoner i blodet efter fasting eller i diabetiske tilfælde.
Eksempler på ketoner
Butanon (C4H8O)
Også kendt som MEK (eller MEC), fremstilles denne væske i stor skala i industrien og anvendes som opløsningsmiddel.
Cyclohexanon (C6H10O)
Fremstillet i massiv skala anvendes denne keton som en forstad til det syntetiske nylonmateriale.
Testosteron (C19H22O2)
Det er hovedhormonet af den mandlige køn og et anabolsk steroid, der findes hos de fleste hvirveldyr.
Progesteron (C21H30O2)
Endogent steroid og kønshormon involveret i menstruationscyklus, graviditet og embryogenese hos mennesker og andre arter.
referencer
- Wikipedia. (N.D.). Keton. Hentet fra en.wikipedia.org
- Britannica, E. (s.f.). Keton. Hentet fra britannica.com
- University, M. S. (s.f.). Aldehyder og Ketoner. Hentet fra chemistry.msu.edu
- ChemGuide. (N.D.). Introduktion af aldehyder og ketoner. Hentet fra chemguide.co.uk
- Calgary, U. O. (s.f.). Ketoner. Hentet fra chem.ucalgary.ca


