Hydrobromsyre (HBr) struktur, egenskaber, dannelse, anvendelser
den Brombrintesyre er en uorganisk forbindelse, der stammer fra den vandige opløsning af en gas kaldet hydrogenbromid. Dens kemiske formel er HBr og kan overvejes på forskellige måder ækvivalente: som et molekylhydrid eller et hydrogenhalogenid i vand; det vil sige et hydrazid.
I kemiske ligninger skal den skrives som HBr (ac), for at angive, at det er brombrintesyre og ikke gas. Denne syre er en af de stærkeste kendte, endog mere end saltsyre, HCI. Forklaringen herfor ligger i karakteren af dens kovalente binding.
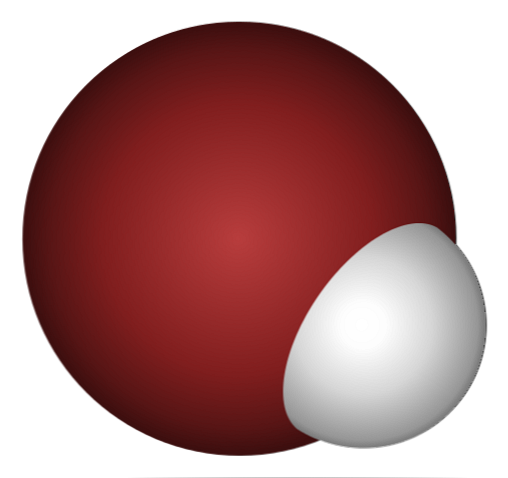
Hvorfor er HBr sådan en syre, og endnu mere opløst i vand? Fordi den kovalente binding H-Br er meget svag på grund af den dårlige overlapning af 1s orbitalerne af H og 4p af Br.
Dette er ikke overraskende, hvis man ser nøje på ovenstående billede, hvor klart bromatomet (brunt) er meget større end hydrogenatomet (hvidt).
Følgelig forårsager enhver forstyrrelse nedbrydning af H-Br-bindingen, frigivelse af H-ionet+. Derefter er brombrintet en Brönsted-syre, da det overfører protoner eller hydrogenioner. Dens styrke er sådan, at den anvendes i syntesen af adskillige organobromerede forbindelser (såsom 1-bromethan, CH3CH2br).
Brombrint er efter hydrisk HI en af de stærkeste og mest anvendelige hydrocider til fordøjelsen af visse faste prøver.
indeks
- 1 Struktur af brombrintesyre
- 1.1 surhed
- 2 Fysiske og kemiske egenskaber
- 2.1 Molekylformel
- 2,2 molekylvægt
- 2.3 Fysisk udseende
- 2.4 lugte
- 2,5 Lugtgrænsen
- 2,6 Tæthed
- 2,7 smeltepunkt
- 2,8 kogepunkt
- 2.9 Opløselighed i vand
- 2,10 Damptæthed
- 2,11 pKa surhed
- 2.12 Kalorikapacitet
- 2.13 Standard molarenthalpi
- 2.14 Standard molar entropi
- 2,15 Flammepunkt
- 3 nomenklaturen
- 4 Hvordan er den dannet?
- 4.1 Blanding af hydrogen og brom i vand
- 4.2 Fosfortribromid
- 4.3 Svovldioxid og brom
- 5 anvendelser
- 5.1 Fremstilling af bromider
- 5.2 Syntese af alkylhalogenider
- 5.3 katalysator
- 6 referencer
Struktur af brombrintesyre
H-Brs struktur er vist på billedet, hvis egenskaber og egenskaber, selv de af gasen, er nært beslægtede med dets vandige opløsninger. Derfor kommer der et punkt, hvor du kommer i forvirring om hvilken af de to forbindelser der henvises til: HBr eller HBr (ac).
Strukturen af HBr (ac) er forskellig fra HBr, fordi vandmolekyler nu solvatiserer dette diatomiske molekyle. Når den er tæt nok overføres H+ til et H-molekyle2Eller som angivet i den følgende kemiske ligning:
HBr + H2O => Br-- + H3O+
Således består strukturen af brombrintesyren af Brioner-- og H3O+ interagerer elektrostatisk. Nu er det lidt anderledes end H-Br's kovalente binding.
Dens store surhed skyldes den omfangsrige anion Br- kan næppe interagere med H3O+, ude af stand til at forhindre ham i at overføre H+ til en anden omgivende kemiske art.
surhed
For eksempel er Cl- og F- selvom de ikke danner kovalente bindinger med H3O+, de kan interagere gennem andre intermolekylære kræfter, såsom brintbroer (som kun F- er i stand til at acceptere dem). Brintbroerne F--H-OH2+ "Hinder" donationen af H+.
Det er af denne grund, at flussyre, HF, er en svagere syre i vand end brombrintesyre; siden de ioniske interaktioner Br- H3O+ ikke genere overførslen af H+.
Selvom vand er til stede i HBr (ac), svarer dens adfærd ved slutningen af kontoen til den for et H-Br-molekyle; det vil sige en H+ Det overføres fra HBr eller Br-H3O+.
Fysiske og kemiske egenskaber
Molekylformel
HBr.
Molekylvægt
80.972 g / mol. Bemærk at, som nævnt i det foregående afsnit, betragtes kun HBr og ikke vandmolekylet. Hvis molekylvægten er taget fra formlen Br-H3O+ det ville have en værdi på 99 g / mol ca..
Fysisk udseende
Farveløs eller lysegul væske, som afhænger af koncentrationen af opløst HBr. Jo mere gul det er, desto mere koncentreret og farligt vil det være.
lugt
Acrid, irriterende.
Lugtgrænsen
6,67 mg / m3.
tæthed
1,49 g / cm3 (vandig opløsning ved 48% vægt / vægt). Denne værdi, som dem, der svarer til smelte- og kogepunkterne, afhænger af mængden af HBr opløst i vandet.
Smeltepunkt
-11ºC (12ºF, 393ºK) (vandig opløsning ved 49% vægt / vægt).
Kogepunkt
122 ° C (252 ° F 393 ° K) ved 700 mmHg (vandig opløsning 47-49% vægt / vægt).
Opløselighed i vand
-221 g / 100 ml (ved 0 ºC).
-204 g / 100 ml (15 ºC).
-130 g / 100 ml (100 ºC).
Disse værdier henviser til gasformig HBr, ikke til brombrintesyre. Som det kan ses, reducerer temperaturstigningen opløseligheden af HBr; adfærd, der er naturlig i gasser. Hvis der kræves koncentrerede HBr (ac) opløsninger, er det derfor bedre at arbejde med dem ved lave temperaturer.
Ved arbejde ved høje temperaturer vil HBr undslippe i form af gasformige diatomiske molekyler, så reaktoren skal forsegles for at forhindre lækage.
Damptæthed
2,71 (i forhold til luft = 1).
Acidity pKa
-9,0. Denne konstante så negative er tegn på dens store styrke af surhed.
Calorisk kapacitet
29,1 kJ / mol.
Standard molarenthalpi
198,7 kJ / mol (298 ºK).
Standard molar entropi
-36,3 kJ / mol.
Antændelsespunkt
Ikke brandfarlig.
nomenklatur
Dets navn "brombrintesyre" kombinerer to fakta: tilstedeværelsen af vand, og at brom har en valens på -1 i forbindelsen. På engelsk er det noget mere tydeligt: brombrintesyre, hvor præfikset "hydro" (eller hydro) refererer til vand; selvom det virkelig kan henvise til brint.
Brom har en valens på -1, fordi den er bundet til hydrogenatomet mindre elektronegative end det er; men hvis det er forbundet eller interagerer med iltatomer, kan det have mange valenser, såsom: +2, +3, +5 og +7. Med H kan kun vedtage en enkelt valens, og derfor er suffikset -ico tilføjet til dets navn.
Mens HBr (g), brintbromid er vandfrit; det vil sige, det har ikke vand. Derfor er den navngivet under andre nomenklaturstandarder, svarende til hydrogenhalogenider.
Hvordan er det dannet?
Der er flere syntetiske metoder til fremstilling af brombrintesyre. Nogle af dem er:
Blanding af hydrogen og brom i vand
Uden at beskrive de tekniske detaljer kan denne syre opnås fra den direkte blanding af hydrogen og brom i en reaktor fyldt med vand.
H2 + br2 => HBr
På denne måde opløses HBr i vandet som HBr danner Dette kan trække det i destillationerne, så løsninger kan udvindes med forskellige koncentrationer. Brint er en gas, og brom er en mørk rødlig væske.
Fosfortribromid
I en mere udførlig proces blandes sand, hydratiseret rød fosfor og brom. Vandfælder er anbragt i isbade for at forhindre HBr i at undslippe og danne, i stedet for brombrintesyre. Reaktionerne er:
2P + 3Br2 => 2PBr3
pBR3 + 3H2O => 3HBr + H3PO3
Svovldioxid og brom
En anden måde at forberede det på er at reagere brom med svovldioxid i vand:
br2 + SW2 + 2H2O => 2HBr + H2SW4
Dette er en redox reaktion. The Br2 det reducerer, det vinder elektroner ved at forbinde med hydrogenerne; mens SO2 det oxiderer, det taber elektroner, når det danner mere kovalente bindinger med andre oxygener, som i svovlsyre.
applikationer
Fremstilling af bromider
Bromsaltene kan fremstilles, hvis HBr (ac) omsættes med et metalhydroxid. For eksempel overvejes produktionen af calciumbromid:
Ca (OH)2 + 2HBr => CaBr2 + H2O
Et andet eksempel er for natriumbromid:
NaOH + HBr => NaBr + H2O
Således kan mange af de uorganiske bromider fremstilles.
Syntese af alkylhalogenider
Og hvad med organiske bromider? Disse er organobromerede forbindelser: RBr eller ArBr.
Dehydrering af alkoholer
Råmaterialet til opnåelse af dem kan være alkoholer. Når de protoneres af surheden af HBr, danner de vand, hvilket er en god udgående gruppe, og i stedet er det voluminøse atomer af Br inkorporeret, som vil blive kovalent bundet til carbonet:
ROH + HBr => RBr + H2O
Denne dehydrering udføres ved temperaturer over 100 ° C for at lette bruddet af R-OH-bindingen2+.
Tilsætning til alkener og alkyner
HBr-molekylet kan tilsættes fra dets vandige opløsning til den dobbelte eller tredobbelte binding af en alken eller alkyn:
R2C = CR2 + HBr => RHC-CRBr
RC = CR + HBr => RHC = CRBr
Flere produkter kan opnås, men under enkle betingelser dannes produktet først, hvor brom er forbundet med et sekundært, tertiært eller kvaternært carbon (Markovnikov-regel).
Disse halogenider griber ind i syntesen af andre organiske forbindelser, og deres anvendelsesområde er meget omfattende. Desuden kan nogle af dem endda bruges i syntese eller design af nye lægemidler.
Eterisk kliv
Fra etherne kan to alkylhalogenider opnås samtidigt, hvor hver af de to sidekæder R eller R 'i den oprindelige ether R-O-R' bærer hinanden. Det sker noget, der ligner dehydrering af alkoholer, men dets reaktionsmekanisme er anderledes.
Reaktionen kan skematiseres med den følgende kemiske ligning:
ROR '+ 2HBr => RBr + R'Br
Og vand er også frigivet.
katalysator
Dets surhed er sådan, at den kan anvendes som en effektiv syrekatalysator. I stedet for at tilføje Br anion- til den molekylære struktur åbner vejen for et andet molekyle at gøre det.
referencer
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10th udgave.). Wiley Plus.
- Carey F. (2008). Organisk kemi (Sjette udgave). Mc Graw Hill.
- Steven A. Hardinger. (2017). Illustreret ordliste for organisk kemi: Brombrintesyre. Hentet fra: chem.ucla.edu
- Wikipedia. (2018). Brombrintesyre. Hentet fra: en.wikipedia.org
- Pubchem. (2018). Brombrintesyre. Hentet fra: pubchem.ncbi.nlm.nih.gov
- Institut for Sikkerhed og Hygiejne på Arbejdspladsen. (2011). Hydrogenbromid [PDF]. Hentet fra: insht.es
- PrepChem. (2016). Fremstilling af brombrintesyre. Hentet fra: prepchem.com


