Egenskaber for natriumdichromat, produktion, farer og anvendelser
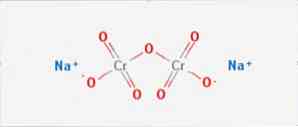
den natriumdichromat er en uorganisk forbindelse med formlen Na2Cr207. Det er en af mange hexavalente chromforbindelser (Cr VI). Dens struktur er illustreret i figur 1, men sædvanligvis håndteres saltet i dets dihydrerede form, hvis formel ville være Na2Cr207 · H2O.
Det har to ionbindinger mellem natriummolekylerne og de negativt ladede oxygener. Krommalmen ekstraheres fra natriumdichromat. Millioner kilogram natriumdichromat produceres årligt.
Kina er den største producent af natriumdichromat dog kinesiske kemiske fabrikker har en forholdsvis lav produktion, mindre end 50.000 tons om året hver, sammenlignet med Kazakstan anlæg, der producerer mere end 100.000 tons om året.
Planter i Rusland, USA og Det Forenede Kongerige har en mellemproduktion på mellem 50.000 og 100.000 tons om året (Kogel, 2006).
Hvad angår reaktivitet og udseende, har natriumdichromat egenskaber svarende til kaliumdichromat, men natriumsaltet er mere opløseligt i vand og har en vægtækvivalent mindre end kaliumsaltet.
Natriumdichromat producerer giftige kromdampe ved opvarmning. Det er et stærkt oxidationsmiddel og er yderst ætsende.
Denne forbindelse kan findes i drikkevandskilder forurenet af forskellige industrielle processer som galvanisering eller galvaniseringsteknikker, læderfarvning og tekstilfremstilling.
indeks
- 1 Fysiske og kemiske egenskaber
- 2 produktionsmetoder
- 3 Reaktivitet og farer
- 4 anvendelser og applikationer
- 5 Biochemistry
- 6 referencer
Fysiske og kemiske egenskaber
Natriumdichromat er sammensat af krystaller med en rødlig orange monoklinisk struktur i deres vandfri og lugtfri form. Dens molekylvægt er 261,97 g / mol i sin vandfri form og 298,00 g / mol i dens dihydrerede form.
Den har et smeltepunkt på 356,7 grader Celsius, et kogepunkt på 400 grader Celsius, hvori det nedbrydes. Den har en densitet på 2,52 g / ml.

Figur 2 viser udseendet af natriumdichromat. Dets opløselighed i vand er 187 g pr 100 g ved 25 grader Celsius og dets opløselighed i ethanol er 513,2 gram per liter til 19,4 grader Celsius (National Center for Biotechnology Information, S. F.).
Det betragtes som en stabil forbindelse, hvis den opbevares under de anbefalede betingelser og ikke er brandfarlig. Da det er et stærkt oxidationsmiddel, er det ætsende, og i opløsning er det surt, der har evnen til at sænke pH til 4 i en opløsning på 1% vægt / volumen.
Produktionsmetoder
Natriumchromat kan omdannes til dichromat ved en kontinuerlig proces, der behandler med svovlsyre, kuldioxid eller en kombination af disse to.
Fordampningen af natriumdichromatvæsken bevirker udfældningen af natriumsulfat og / eller natriumbicarbonat, og disse forbindelser fjernes før den endelige krystallisation af natriumdichromat..
Natriumdichromat kan udføres i en tre-trins proces:
- Alkalisk ristning af chromitoxidationsbetingelser
- Udvaskning. Ekstraktion af opløseligt stof fra en blanding ved virkningen af et flydende opløsningsmiddel
- Omdannelse af natriummonochromat i natriumdichromat ved hjælp af en syre.
Vandfrit natriumdichromat kan fremstilles ved at smelte natriumdichromat dihydrat, krystallisering vandige opløsninger af dichromat over 86 grader C, eller tørring opløsninger af natriumdichromat i spraytørrere.
Natriumdichromatopløsninger ved 69 og 70% vægt / volumen anvendes som en bekvem og omkostningseffektiv metode til at sende mængder, idet man undgår behovet for manuel håndtering eller opløsning af krystaller.
Reaktivitet og farer
Det er et stærkt oxidationsmiddel. Uforenelig med stærke syrer. Kontakt med brændbare materialer kan forårsage brande. Giftige dampe af kromoxid kan dannes i nærvær af varme eller ild.
Den kendte "chromsyreblanding" af dichromat og svovlsyre med organiske rester giver anledning til en voldsom eksoterm reaktion. Denne blanding i kombination med acetonrester fører også til en voldsom reaktion.
Kombinationen af dichromat og svovlsyre med alkoholer, ethanol og 2-propanol giver anledning til en voldsom eksoterm reaktion. På grund af forekomsten af mange hændelser, der involverer blanding af dichromatsvovlsyre med oxiderbare organiske materialer, er det sandsynligvis bedst at undgå sådanne interaktioner.
Kombinationen af dichromat med hydrazin er eksplosiv, dikromatreaktionen kan forventes at være kraftig med aminer generelt. Tilsætningen af det dehydrerede dichromatsalt til eddikesyreanhydrid fører til en endelig eksplosiv eksoterm reaktion.
Bor, silicium og dichromater danner pyrotekniske blandinger. En blanding af eddikesyre, 2-methyl-2-pentenal og dichromat fører til en rampant reaktion (Chemical Data Sheet Sodium Dichromate., 2016).
Indånding af støv eller tåge forårsager åndedrætsirritation, der undertiden ligner astma. Septal perforering kan forekomme. Det betragtes som gift.
Indtagelse forårsager opkastning, diarré og meget usædvanligt komplikationer i mave og nyre. Kontakt med øjne eller hud forårsager lokal irritation. Gentagen udsættelse for huden forårsager dermatitis.
Natriumdichromat er et kræftfremkaldende stof hos mennesker. Der er tegn på, at hexavalente chromforbindelser eller Cr (VI) kan forårsage lungekræft hos mennesker. Det har vist sig, at natriumdichromat forårsager lungekræft hos dyr.
Mens natriumdichromat ikke er blevet identificeret som en teratogen forbindelse eller reproduktiv risiko er det kendt, at forbindelser med hexavalent chrom Cr (VI) er teratogener og forårsage reproduktiv skade og nedsætte fertiliteten og forstyrre menstruationscyklus.
Natriumdichromat kan forårsage lever- og nyreskade, så det skal håndteres med stor omhu (New Jersey Department of Health, 2009).
Ved indtagelse skal ofret drikke vand eller mælk; Fremkald aldrig opkastning. Ved kontakt med hud eller øjne skal det behandles som syreforbrændinger; Skyl dine øjne med vand i mindst 15 minutter.
Eksterne læsioner kan gnides med en 2% opløsning af natriumthiosulfat. I alle tilfælde bør en læge konsulteres.
Anvendelser og applikationer
Bortset fra dets betydning ved fremstillingen af andre kromkemikalier har natriumdichromat også mange direkte anvendelser som ingrediens i produktionen af:
- Metallisk finish: hjælper korrosionsbestandigheden og renser metaloverfladerne, og favoriserer også malingens vedhæftning.
- Økologiske produkter: anvendes som oxidationsmidler til fremstilling af produkter som vitamin K og voks.
- Pigmenter: Anvendes til fremstilling af uorganiske chromatpigmenter, hvor det producerer en række farver, der er stabile til lys. Nogle grader af chromat anvendes også som inhibitorer af korrosion i de nedre lag og primere.
- Keramisk: bruges til fremstilling af farvede glas og keramiske glasurer.
- Tekstil: Anvendes som en mordant for sure farvestoffer til forbedring af dets hurtigfarveegenskaber.
- Produktion af chromsulfat.
(Sodium dichromate, byggestenen for stort set alle andre chromforbindelser., 2010-2012)
Natriumdichromat Dihydrat, dets anvendelse er ideel i forskellige forhold, herunder højtemperaturanvendelser, såsom keramiske glasurer og farvet glas.
Kromoxid, der er sværere end andre metaloxider, såsom titanium eller jern, er ideel til miljøer, hvor temperatur- og procesforholdene er aggressive.
Dette stof anvendes hovedsageligt til fremstilling af andre chromforbindelser, men det anvendes også i bentonitmudder, der anvendes til produktion af olie, i træbeskyttelsesmidler, til fremstilling af organiske kemikalier og som korrosionsinhibitor..
Når det blandes med aluminium- og kaliumdichromat, ved anvendelse af den alumino-termiske proces, frembringer det chromoxid et højt rent metallisk chrom. Dette er en vigtig ingrediens i produktionen af højtydende superlegeringer, der anvendes inden for rumfartsindustrien.
Ved organisk syntese anvendes natriumdichromat som et oxidationsmiddel i reduktionsoxidreaktioner i nærvær af svovlsyre.
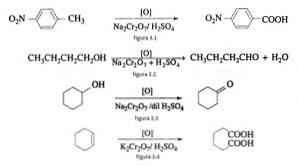
For eksempel oxidationen af p-nitrotoluen til dannelse p-nitrobenzoesyre, i oxidation af n-butanol til dannelse af n-butaldehido, i dannelsen af cyklohexanon fra cyclohexanol og dannelsen af adipinsyre som vist i fig 3.1 , 3,2, 3,3 og 3,4 (VK Ahluwalia, 2004).
biokemi
Intratracheal instillation af natriumdichromat (CrVI) og chromacetat hydroxid (CrIII) i hanrotter resulterede i forhøjede koncentrationer af chrom er fuldblod, plasma og urin op til 72 timer efter eksponering; De maksimale koncentrationer blev nået 6 timer efter eksponering.
Forholdet mellem helblodkrom og plasmakromkoncentrationer var signifikant anderledes for Cr (VI) og Cr (III) behandlingerne. Derfor bør analyser af krom i blod og krom i plasma anvendes til evaluering af kromeksponering.
Chrom blev også påvist i perifere lymfocytter. Cr (VI), men ikke Cr (III) akkumulerede signifikant i lymfocytter efter behandling. Disse celler har potentialet til at blive anvendt som biomarkører i vurderingen af eksponering for chromforbindelser (Hooth, 2008).
referencer
- Kemisk datablad Natriumdichromat. (2016). Hentet fra cameo kemikalier: cameochemicals.noaa.
- Hooth, M.J. (2008). Teknisk rapport om toksikologi og kræftfremkaldende studier af natriumdichromatdihydrated. National Institute of Health USA.
- Kogel, J. E. (2006). Industrielle mineraler og klipper: Råvarer, markeder og anvendelser syvende udgave. littleton colorado: samfund af minedrift, metallurgi og udforskning inc.
- National Center for Bioteknologi Information. (N.D.). PubChem Compound Database; CID = 25408. Hentet fra pubchem.com: pubchem.ncbi.nlm.nih.gov.
- New Jersey Department of Health. (2009, november). Hazardous Substance Fact Sheet Natriumdichromat. Hentet fra nj.gov: nj.gov.
- Natriumdichromat. Bygningsblokken til stort set alle andre kromforbindelser. (2010-2012). Hentet fra elementskrom: elementischromium.com
- K. Ahluwalia, R. A. (2004). Omfattende praktisk organisk kemi: Forberedelser og kvantitative analyser. Delhi: Universitetspressen (Indien).


