Natriumsulfat Formel, Egenskaber, Struktur, Anvendelser
den natriumsulfat (dinatriumsalt af svovlsyre, dinatriumtetraoxidosulfat, natriumsulfat, salt af Glauber, thenardit, mirabilit) er den uorganiske forbindelse med formlen Na2SW4 og dets beslægtede hydrater. Alle former er hvide faste stoffer, der er stærkt opløselige i vand.
Det betragtes som et af de vigtigste kemiske produkter, der markedsføres. Dens verdensomspændende produktion (næsten udelukkende i form af decahydrat) udgør ca. 6 mio. Tons om året.

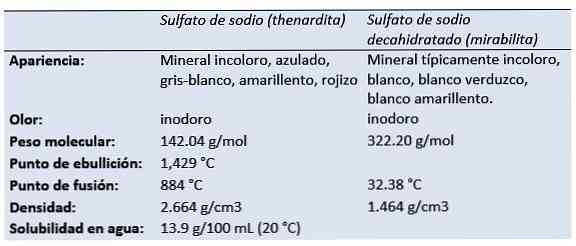
Thenardite er det vandfrie natriumsulfatmineral, der produceres i tørre fordampningsmiljøer, i tørgrotter, i gamle minedrift som udslip og som depositum omkring fumaroler.
Det blev først beskrevet i 1825 i Salinas Espartinas (Ciempozuelos, Madrid, Spanien) og blev navngivet thenardita til ære for den franske kemiker Louis Jacques Thénard (1777-1826).

Dutch / tyske kemiker og drogist Rudolf Johann Glauber (1604-1670) opdaget i 1625, i vandet i en østrigsk fjeder, decahydrat natriumsulfat (senere kendt som Glauber salt). Han kaldte det mirabilis salt (mirakuløst salt) på grund af dets medicinske egenskaber.
Mellem 1650 og 1660 begyndte Glauber at fremstille natriumsulfat fra almindeligt salt (NaCl) og koncentreret svovlsyre. Denne proces betragtes som begyndelsen af den kemiske industri.
Dens krystaller blev brugt som afføringsmiddel indtil det 20. århundrede.
I det attende århundrede begyndte reaktionen af Glauber's salt med kaliumcarbonat (kaliumcarbonat) at blive anvendt i industriel produktion af sodavand (natriumcarbonat).

Det anvendes i øjeblikket hovedsagelig til fremstilling af vaske- og rengøringsmidler og i Kraft-processen til fremstilling af papirmasse (den dominerende metode til fremstilling af papir).
Natriumsulfat mineralforekomster findes i USA, Canada, Spanien, Italien, Tyrkiet, Rumænien, Mexico, Botswana, Kina, Egypten, Mongoliet og Sydafrika.
De vigtigste producenter er Kina (provinser Jiangsu og Sichuan), efterfulgt af Spanien, hvor den største glauberit depositum i verden er placeret (i Cerezo de Río Tirón, Burgos).
Den samlede verdensproduktion af naturligt natriumsulfat anslås til ca. 8 millioner tons, og det opnås som et biprodukt af andre industrielle processer mellem 2 og 4 Mt.
I Spanien, ifølge oplysninger på National Resource Inventory Sulfate og andre opdaterede data, lagre af mineraler af natriumsulfat i størrelsesordenen 730 Mt opført som "reserver" skønnes, og 300 Mt klassificeret som "andre ressourcer".
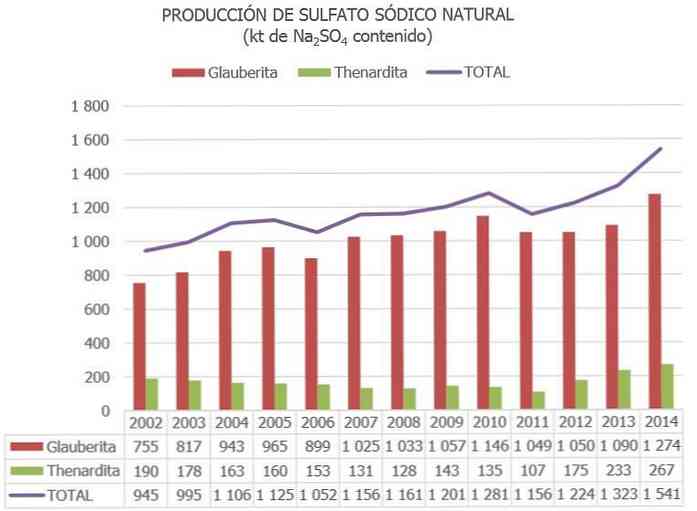
I EU er Spanien for tiden det eneste land med malmer af natriumsulfat (hovedsagelig af Thenardite, Glauberite og Mirabilite).
I øjeblikket er der generelt fald i efterspørgslen efter natriumsulfat i tekstilsektoren.
I de senere år har andre sektorer som vaskemidler oplevet en vis vækst i visse regioner på grund af deres lave pris som råmateriale.
De vigtigste ekspanderende markeder for natriumsulfatvaskemidler findes i Asien, Mellemamerika og Sydamerika.
formler

2D struktur
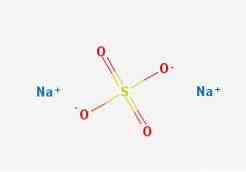
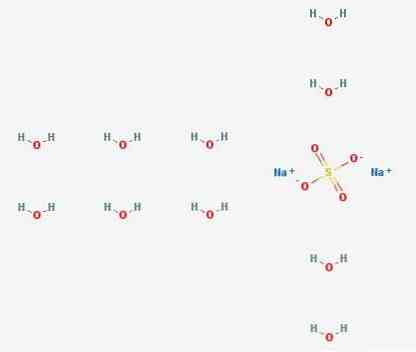
3D struktur
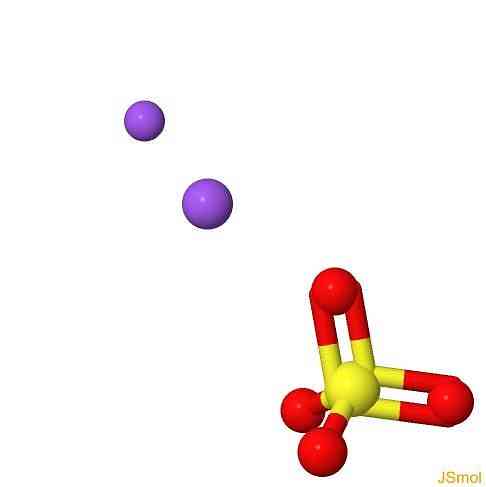
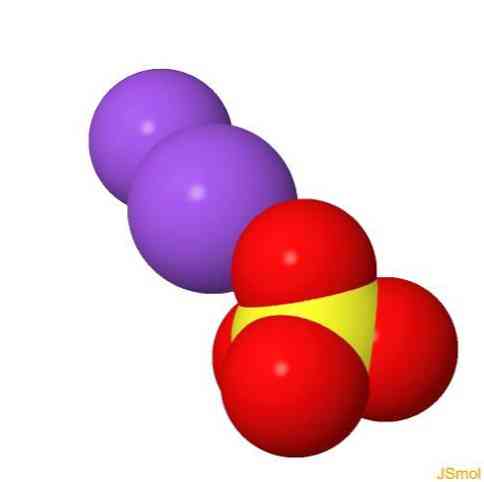
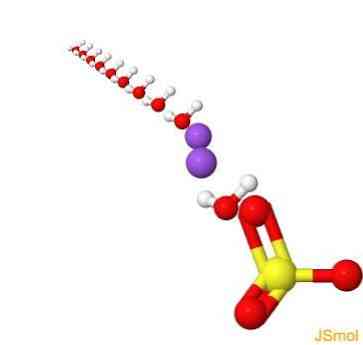
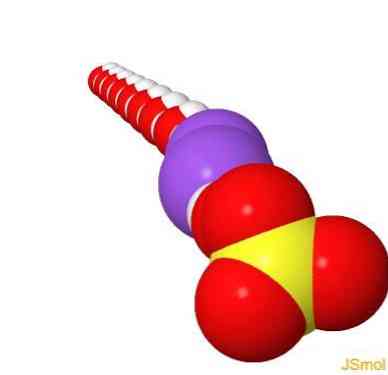
funktioner
Fysiske og kemiske egenskaber
Natriumsulfat tilhører den reaktive gruppe af natriumforbindelser og tilhører også gruppen af sulfater, hydrogen sulfater og disulfitter.
antændelighed
Det er et ikke brændbart stof. Der er ingen risiko for eksplosion af dets pulvere.
reaktivitet
Natriumsulfat er meget opløseligt i vand og hygroskopisk. Det er meget stabilt, er ikke-reaktivt over for de fleste oxidations- eller reduktionsmidler ved normale temperaturer. Ved høje temperaturer kan den omdannes til natriumsulfid ved carbotermisk reduktion.
Kemisk ikke-reaktive stoffer betragtes som ikke-reaktive under typiske miljøforhold (selvom de kan reagere under relativt ekstreme omstændigheder eller i katalyse). De er resistente over for oxidation og reduktion (undtagen i ekstreme forhold).
Farlige kemiske reaktioner
Når aluminium smeltes sammen med natrium- eller kaliumsulfat, opstår der en voldsom eksplosion.
toksicitet
Kemisk ikke-reaktive stoffer betragtes som giftige (selvom gasformige stoffer fra denne gruppe kan fungere som asphyxiants).
Selvom natriumsulfat generelt betragtes som giftfri, skal det håndteres med omhu. Pulveret kan forårsage astma eller midlertidig øjenirritation. Denne risiko kan undgås ved at bære øjenbeskyttelse og en papirmask.
applikationer
Dens vigtigste anvendelser er i fremstillingen af:
- vaskemiddelpulver.
- papirmasse.
- tekstiler.
- glas.
- syntese af enzymer (vinfremstilling).
- menneskelig og animalsk mad.
- apoteksprodukter.
- grundlæggende kemi generelt.
- stålprocesser.
- Vaskemiddelpulver
Natriumsulfat er et meget billigt materiale. Dens største anvendelse er som fyldstof i husholdnings pulvervaskemidler, der indtager ca. 50% af verdensproduktionen. De nye kompakte eller flydende rengøringsmidler omfatter ikke natriumsulfat, så denne brug er faldende.
En anden anvendelse af natriumsulfat, der er aftagende, især i USA. og Canada, er i Kraft-processen til fremstilling af træmasse. Forbedringer i procesens termiske effektivitet reducerede drastisk behovet for natriumsulfat.
Glasindustrien giver en anden vigtig anvendelse for natriumsulfat. Det er den næststørste applikation i Europa. Natriumsulfat bruges til at fjerne små luftbobler fra smeltet glas.
I Japan er den største anvendelse af natriumsulfat i fremstillingen af tekstiler. Natriumsulfat hjælper farvestofferne til at trænge jævnt ind i fibrene og korroderer ikke de rustfrit stålskibe, der anvendes til farvning (i modsætning til natriumchlorid, hvilket er den alternative metode).
Natriumsulfat er især egnet til lagring af solvarme lav kvalitet (til senere frigivelse i opvarmning) på grund af sin høje lagerkapacitet på varme under faseændringen fra fast til flydende, som er givet ved 32 ° C.
Til køleanvendelser reducerer en blanding med natriumchlorid (NaCl) almindeligt salt smeltepunktet til 18 ° C.
I laboratoriet anvendes vandfrit natriumsulfat i vid udstrækning som et inert tørremiddel for at fjerne spor af vand fra organiske opløsninger. Dens virkning er langsommere end magnesiumsulfat, men den kan anvendes med en række forskellige materialer, da det er kemisk ret inert.
Natriumsulfat decahydrat (Glauber's salt) blev historisk anvendt som afføringsmiddel. Det er effektivt til fjernelse af visse lægemidler som acetaminophen (acetaminophen) fra kroppen efter en overdosis.
Andre anvendelser for natriumsulfat omfatter dets anvendelse som tilsætningsstof til fremstilling af tætsluftforfriskere som tilsætningsstof til husdyrfoder og til fremstilling af stivelse.
Kliniske virkninger
Til sine terapeutiske anvendelser hører natriumsulfat til kategorien af saltvand og katartiske afføringsmidler, der anvendes til behandling af forstoppelse.
Saline-katetre er salte, der bevarer væsker i tarmene ved den osmotiske virkning af det ikke absorberede salt, hvilket indirekte frembringer en stigning i peristaltisk.
Saline cathartics absorberes dårligt af mave-tarmkanalen, derfor er systemisk toksicitet usandsynligt, medmindre massive mængder er indtaget. Store eksponeringer kan dog forårsage dehydrering og elektrolytændringer, der er sekundære for de osmotiske virkninger af forbindelsen.
Kronisk laxerende overgreb kan forekomme hos patienter med spiseforstyrrelser, Munchausen syndrom eller voldelige lidelser. Generelt oplever patienter kvalme, opkastning og diarré i forbindelse med kramper i maven. Alvorlige virkninger kan omfatte dehydrering, hypotension, hypernatremi og elektrolytabnormiteter.
Sikkerhed og risici
Fareerklæringer for det globalt harmoniserede system til klassificering og mærkning af kemikalier (SGA).
Den globale harmoniserede system for klassificering og mærkning af kemikalier (GHS) er en internationalt anerkendt system, skabt af FN designet til at erstatte de forskellige klassifikationssystemer standarder og mærkning, der anvendes i forskellige lande, der bruger konsekvente kriterier på verdensplan (Nationers United, 2015).
Hazard klasser (og dens tilsvarende kapitel i GHS) standarder klassificering og mærkning og anbefalinger natriumsulfat er som følger (Det Europæiske Kemikalieagentur, 2017 FN, 2015; pubchem, 2017):
Fareklasser i GHS
H315: Forårsager hudirritation [Advarsel Hudkorrosion / irritation - Kategori 2].
H317: Kan forårsage allergisk hudreaktion [Advarselssensibilisering, Hud - Kategori 1].
H319: Forårsager alvorlig øjenirritation [Advarsel Alvorlig øjenskade / øjenirritation - Kategori 2A].
H412: Skadelig for vandlevende organismer med langvarige bivirkninger [Farlig for vandmiljøet, langvarig fare - Kategori 3].
(PubChem, 2017)
Sikkerhedsrådets koder
P261, P264, P272, P273, P280, P302 + P352, P351 + P338 + P305, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363, P501 og.
referencer
- ChemIDplus (2017) 3D-struktur af 7757-82-6 - Natriumsulfat vandfri [billede]. Hentet fra: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D struktur af 7727-73-3 - Natriumsulfat [USP] [billede]. Hentet fra: chem.nlm.nih.gov.
- Dyet, D. (2007) Thenardite Sodium sulfate nær Sodaville Mineral County Nevada [billede] Hentet fra: en.wikipedia.org.
- Det Europæiske Kemikalieagentur (ECHA), (2017). Oversigt over klassificering og mærkning. Harmoniseret klassificering - Bilag VI til forordning (EF) nr. 1272/2008 (CLP-forordningen). Natriumsulfat.
- Grumetisho (2012) Mirabilita [billede] Hentet fra: es.wikipedia.org.
- Datablad for farlige stoffer (HSDB). TOXNET. (2017). Natriumsulfat Bethesda, MD, EU: National Library of Medicine. Hentet fra: toxnet.nlm.nih.gov.
- Geologiske og Mining Institute of Spain (IGME) (2016). GLAUBERITA-THENARDITA (NATURLIG NATRIUMSULFAT) 2014. Mining panorama. Hentet fra: igme.es.
- National Institute for Safety at Work (INSHT). (2010). International Safety Chemical Records. Natriumsulfat. Beskæftigelses- og Sikkerhedsministeriet. Madrid. Det er. Hentet fra: insht.es.
- Langbein Rise (2008) Kontinuerlig kraftmasse mil [billede] Hentet fra: wikimedia.org.
- De Forenede Nationer (2015). Globalt Harmoniseret System til Klassificering og Mærkning af Kemiske Produkter (SGA) Sjette Revideret Udgave. New York, USA: FN-publikation. Hentet fra: unece.org.
- National Center for Bioteknologi Information. PubChem Compound Database (2016) natriumsulfat - PubChem Structure [billede] Bethesda, MD, EU: National Library of Medicine. Hentet fra: pubchem.ncbi.nlm.nih.gov.
- National Center for Bioteknologi Information. PubChem Compound Database (2016) natriumsulfat - PubChem Structure [billede] Bethesda, MD, EU: National Library of Medicine.
- National Center for Bioteknologi Information. PubChem Compound Database. (2017). Natriumsulfat decahydreret. Bethesda, MD, EU: National Library of Medicine. Hentet fra: pubchem.ncbi.nlm.nih.gov.
- National Center for Bioteknologi Information. PubChem Compound Database. (2017). Natriumsulfat Bethesda, MD, EU: National Library of Medicine. Hentet fra: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Natriumsulfat [billede] Hentet fra: wikimedia.org.
- Wikipedia (2017) Kraft-proces. Hentet fra: wikipedia.org.
- Wikipedia (2017) Mirabilita. Hentet fra: wikipedia.org.
- Wikipedia (2017) Mirabilite. Hentet fra: wikipedia.org.
- Wikipedia (2017) Natriumsulfat. Hentet fra: wikipedia.org.
- Wikipedia (2017) Solfato di natrium decaidrate. Hentet fra: https://it.wikipedia.org.
- Wikipedia (2017) Natriumsulfat. Hentet fra: wikipedia.org.
- Wikipedia (2017) Thenardita. Hentet fra: wikipedia.org.
- Wikipedia (2017) Thenardite. Hentet fra: .wikipedia.org.


