Spore-farvningsfundament, teknikker og anvendelser
den spore farvning er metoden anvendt til at farve modstandsstrukturerne, der danner en bakteriel genera, når de er i ugunstige forhold; disse strukturer svarer til en måde at overleve på.
Der er mange slægter, der danner sporer; De vigtigste er dog Bacillus og Clostridium. Disse slægter betragtes som mere relevante, fordi de har patogene arter for mennesker.
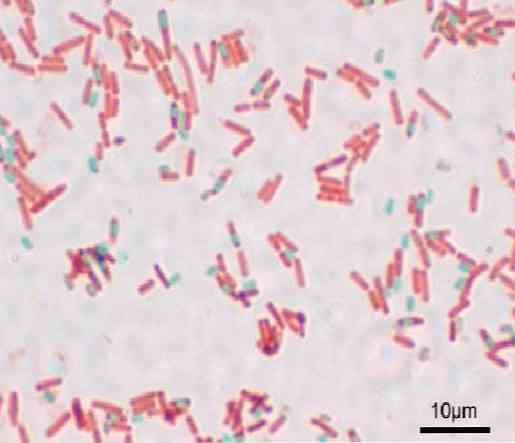
Hver bacillus kan give anledning til en spore. På tidspunktet for farvning af præparatet kan sporen findes inden i bacillus (endospore) eller udenfor (exospore). Med konventionelle farvningsteknikker til bakterier - såsom Gram-plet - forbliver sporer farveløse.
På nuværende tidspunkt er der flere farvemetoder, der kan krydse sporets tykke struktur for at farve det. Disse metoder er meget varierede; Blandt disse kan nævnes Dorner-teknikken, Möeller-flappen og Shaeffer-Fulton-metoden, også kendt som Wirtz-Conklin..
Af alle de nævnte teknikker er Shaeffer-Fulton-metoden den mest anvendte i rutinelaboratorier. Det skylder sit navn på to mikrobiologer, der skabte farvningen i 1930: Alicia Shaeffer og MacDonald Fulton. Imidlertid kaldes teknikken undertiden Wirtz-Conklin til ære for to bakteriologer fra 1900'erne.
indeks
- 1 Foundation
- 2 Spore farvningsteknikker
- 2.1 Dorners teknik
- 2.2 Modificeret Dorner teknik
- 2.3 Teknik af Shaeffer-Fulton eller Wirtz-Conklin
- 2.4 Möeller teknik
- 2.5 Modificeret Möeller teknik uden varme
- 3 anvendelser
- 3.1 Eksempler
- 4 referencer
fundament
Sporerne pletter ikke med konventionelle farvestoffer, fordi de har en meget tyk mur. Spores komplekse sammensætning forhindrer indførelsen af de fleste farvestoffer.
Hvis sporerne studeres udefra til indersiden, observeres følgende lag: For det første er exosporiumet, som er det tyndeste ydre lag dannet af glycoproteiner..
Derefter kommer cuticle, som giver modstand mod høje temperaturer, efterfulgt af cortex sammensat af peptidoglycan. Så er der bunden af bunden, der beskytter protoplastet.
Sporet er en dehydreret struktur, som indeholder 15% calcium og dipikolinsyre. Derfor er de fleste sporfarvningsteknikker baseret på anvendelse af varme, således at farvestoffet kan trænge igennem den tykke struktur.
Når sporet er farvet, kan det ikke fjerne farvestoffet. I Shaeffer-Fulton-teknikken kommer malakitgrøn ind i de vegetative celler, og ved påføring af varme trænger ind i endosporien og også eksosporerne.
Når der vaskes med vand, fjernes farvestoffet fra den vegetative celle. Dette sker fordi den grønne malakitfarvestof er lidt grundlæggende, så den binder svagt til den vegetative celle.
På den anden side kan den ikke komme ud af sporet og endelig er bacillus med safranin modsat. Dette fundament gælder for resten af teknikkerne, hvor noget lignende sker.
Spore farvningsteknikker
For at gøre sporerne plet, skal du have en ren kultur af den mistænkte stamme, du vil studere.
Kulturen udsættes for ekstreme temperaturer i 24 timer for at stimulere mikroorganismen til at sporulere. Til dette kan kulturen anbringes i en ovn ved 44 ° C eller i køleskab (8 ° C) i 24 eller 48 timer.
Hvis der er for meget tid tilbage ved de nævnte temperaturer, vil kun exosporer blive observeret, da alle endosporerne vil have forladt bacillus.
I slutningen af tiden skal et par dråber steril fysiologisk opløsning placeres på et rent dias. Derefter tages en lille del af afgrøden, og der laves en fin spredning.
Derefter bliver det tørt, det er fastgjort til varmen, og det er farvet med nogle af de teknikker, der forklares nedenfor:
Dorners teknik
1 - Forbered i et reagensglas en koncentreret suspension af sporuleret mikroorganisme i destilleret vand og tilsæt et lige stort volumen filtreret Kinyoun phenol fuchsin.
2- Sæt røret i et bad med kogende vand i 5 til 10 minutter.
3- På et rent dias blandes en dråbe af den foregående suspension med en dråbe 10% nigrosin vandig opløsning, koges og filtreres.
4- Udvid og tør hurtigt med mild varme.
5- Undersøg med 100X objektiv (nedsænkning).
Sporerne pletter rødt og bakteriecellerne vises næsten farveløse mod en mørkegrå baggrund.
Modificeret Dorner teknik
1- En suspension af sporuleret mikroorganisme spredes på et objektglas og fikseres til varmen.
2- Prøven er dækket med en strimmel filterpapir, hvortil der tilsættes finsyrefuchsin. Farvestoffet opvarmes i 5 til 7 minutter med Bunsen-brænderens flamme, indtil udslip af dampe dannes. Derefter fjernes papiret.
3- Vask præparatet med vand og tør derefter med absorberende papir.
4- Dæk smøret ud med en tynd film på 10% nigrosin, ved hjælp af et andet dias for at sprede nigrosin eller en nål.
Farvningen taget af sporer og bakterier er den samme som den, der er beskrevet i den kendte teknik.
Shaeffer-Fulton eller Wirtz-Conklin teknik
1- Lav en tynd spredning med en suspension af sporuleret mikroorganisme på et dias og fiks det til opvarmning.
2- Tag dækslet op med en vandig opløsning af 5% malachitgrøn (et filterpapir kan placeres på pladen).
3- Varme på Bunsen-brænderens flamme for at få damp til at undslippe og fjerne flammen. Gentag operationen i 6 til 10 minutter. Hvis malachit grøn opløsning under proceduren fordamper for meget, kan der tilsættes flere.
4- Fjern filterpapiret (hvis det blev placeret) og vask med vand.
5- Tag dækslet med 0,5% vandigt safranin i 30 sekunder (nogle varianter af teknikken bruger 0,1% vandig safranin og lad det stå i 3 minutter).
Med denne teknik er sporerne grønne og bacillerne er røde.
Det har den ulempe, at endosporerne af unge kulturer ikke pletter godt, da de ser yderst klare eller farveløse ud. For at undgå dette anbefales det at bruge kulturer på 48 timers inkubation.
Möeller teknik
1- Dæk smøret ud med chloroform i 2 minutter.
2- Kassér chloroformen.
3- Cover med 5% chromsyre i 5 minutter.
4- Vask med destilleret vand
5- Pladen er dækket af fuchsin-phenol karper og udsat for Bunsen-brænderens flamme, indtil dampens udledning så fjernes det fra flammerne i et øjeblik. Operationen gentages, indtil den når 10 minutter.
6- Vask med vand.
7- Brug forsuret ethanol (saltsyre) til affarvning. Den er tilbage i 20 eller 30 sekunder.
8- Vask med destilleret vand.
9-Modvirkning dækker arket med methylenblåt i 5 minutter.
10- Vask med destilleret vand.
11- Det tørres, og prøven tages under et mikroskop.
Sporer ser rød og blå baciller. Det er vigtigt ikke at indånde dampene, fordi de er toksiske og på lang sigt kan de være kræftfremkaldende.
Modificeret Möeller teknik uden varme
I 2007 skabte Hayama og hans samarbejdspartnere en modifikation af Möeller-teknikken. De fjernede opvarmningstrinnet af farvestoffet og erstattede det med tilsætning af 2 dråber af Tergitol 7-overfladeaktivt middel til hver 10 ml fuchsin-phenolcarbolisk opløsning. De samme resultater blev opnået.
applikationer
Sporfarverne giver en meget værdifuld og nyttig information til identifikation af patogenet, da tilstedeværelsen af det samme, dets form, placeringen i bacillus og evnen til at deformere den vegetative celle eller ej, er data, som kan lede arten involveret inden for et bestemt køn.
I den sammenhæng er det værd at nævne, at sporerne kan være runde eller ovale, de kan være placeret i centrum eller også i paracentral, subterminal eller terminal stilling.
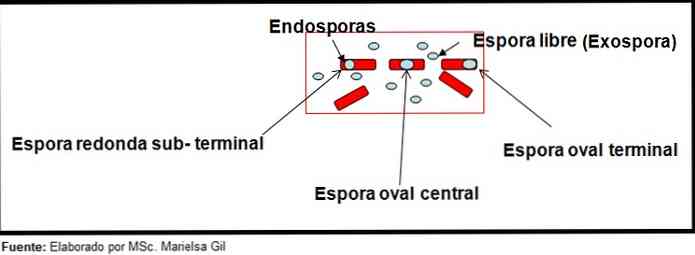
eksempler
- Clostridium difficile danner en oval spore i terminal stilling, der deformerer bacillus.
- Sporet af Clostridium tertium Det er ovalt, deformer ikke bacillus og er placeret på terminalniveau.
- Endosporien af Clostridium tetani den er terminal og deformerer bacillusen og giver udseendet af en tromle.
- Sporene af Clostridium botulinum, C. histolyticum, C. Novy og C. septicum de er runde eller subterminale ovale og deformere bacillus.
- Endosporien af Clostridium sordelli Den er placeret i den centrale position med en lille deformation.

referencer
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Forslag til en forenklet teknik til farvning af bakterielle sporer uden anvendelse af varmelukningsfuld modifikation af Moellers metode. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Wikipedia bidragsydere. Moeller plet. Wikipedia, den frie encyklopædi. 3. november 2018, 03:28 UTC. Tilgængelig på: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Laboratoriehåndbog om mikrobiologiske teknikker. Institut for Grundvidenskab Akademi for Mikrobiologi. National Polytechnic Institute.
- "Endospore." Wikipedia, Den frie encyklopædi. 25. februar 2018, 10:20 UTC. 10 jan 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macias J og samarbejdspartnere. (2006). Arbejdspersonale i det selvstyrende region Extremadura. Særlig dagsorden Volumen IV. Editorial MAD. Sevilla-Spanien, s. 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006). Specialt laboratorietekniker, af den galiciske sundhedstjeneste (SERGAS). Emne-specifik lydstyrke 2. Editorial MAD. Sevilla-Spanien, s. 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. (5. udgave). Argentina, Editorial Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Mikrobiologisk diagnose af Bailey & Scott. 12 udg. Argentina. Panamericana S.A Editorial


