Giemsa-farvningsfundament, materialer, teknik og anvendelser
den Giemsa plet er en slags farvning af kliniske prøver baseret på blandingen af syre og basiske farvestoffer. Dens skabelse blev inspireret af det arbejde, der blev udført af Romanowsky, hvor Gustav Giemsa, kemiker og bakteriolog oprindeligt fra Tyskland, perfekerede det ved at tilføje glycerol for at stabilisere forbindelserne.
Ændringerne, der blev genereret til den oprindelige teknik, Romanowsky, fik lov til at forbedre de mikroskopiske observationer betydeligt, derfor blev teknikken døbt med navnet Giemsa stain.
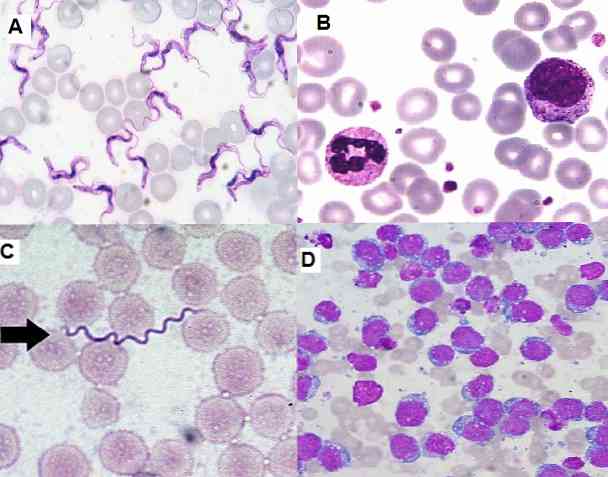
Fordi det er en simpel teknik til at udføre, yderst funktionel og økonomisk, er den i øjeblikket meget udbredt i det kliniske laboratorium for hæmatologiske udslæt, knoglemarvsprøver og vævssektioner..
Giemsa-farvningsteknikken er meget nyttig til cytologiske undersøgelser, da det tillader observation af specifikke strukturer af celler. Denne teknik pletter cytoplasmaerne, kernerne, nukleolerne, vakuolerne og granulerne i cellerne, idet de kan skelne selv fine spor af kromatin.
Derudover kan signifikante ændringer i størrelsen, formen eller farvningen af kernen detekteres, hvor det er muligt at visualisere tabet af kerne-cytoplasmaforholdet.
På den anden side tillader det at identificere umodne celler i knoglemarv og perifert blod, hvilket er vigtigt for diagnosticering af alvorlige sygdomme som leukæmi. Det er også muligt at finde hemoparasitter, ekstra og intracellulære bakterier, svampe, blandt andre.
I cytogenetik er det ret brugt, da det er muligt at studere mitosen af celler.
indeks
- 1 Stiftelsen af Giemsa farve
- 2 materialer
- 2.1 Materialer til fremstilling af moderopløsningen
- 2.2 Forberedelsesmåde af moderopløsningen
- 2.3 Materialer til fremstilling af bufferopløsningen
- 2.4 Endelig fremstilling af farvestoffet
- 2.5 Yderligere materialer, der er nødvendige for at udføre farvningen
- 3 Teknik
- 3.1 Farvningsproces
- 4 Hjælpeprogrammer
- 4.1 Hematologi
- 4.2 Mykologi
- 4.3 Bakteriologi
- 4.4 Parasitologi
- 4,5 cytologi
- 4.6 Cytogenetika
- 5 Forskning, der demonstrerer effektiviteten af Giemsa-farvning
- 6 Anbefalinger til god farvning
- 7 Almindelige fejl i farvningen af Giemsa
- 7.1 Ekstremt blå farve
- 7.2 Overdriven lyserød farve
- 7.3 Tilstedeværelse af bundfald i smøret
- 7.4 Tilstedeværelse af morfologiske artefakter
- 8 Opbevaringstilstand
- 9 Referencer
Stiftelsen af Giemsa farve
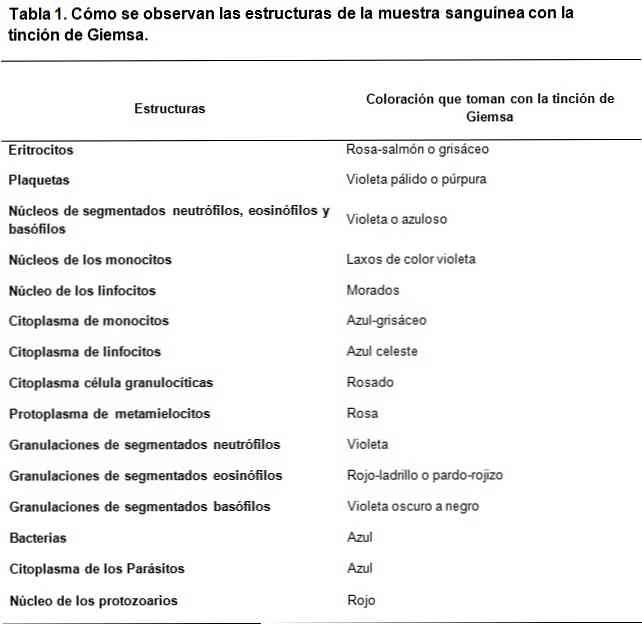
Romanowsky-typen farvestoffer er baseret på brugen af en kontrast mellem syre og basiske farvestoffer, for at opnå farvning af henholdsvis basiske og sure strukturer. Som det kan ses er der en affinitet af syrefarverne til at farve de grundlæggende strukturer og omvendt.
Det anvendte basiske farvestof er methylenblåt og dets oxiderede derivater (Azure A og Azure B), mens syrefarvestoffet er eosin.
Syrstrukturerne af cellerne er nukleinsyrerne, granulerne af de segmenterede basofiler, blandt andet, derfor vil de blive farvet med methylenblåt.
På samme måde er de grundlæggende strukturer af cellerne hæmoglobin og nogle granuler, såsom de indeholdt i de segmenterede eosinofiler, blandt andre; disse vil blive farvet med eosin.
På den anden side kan, på grund af det faktum, at methylenblåt og azurblåt karakteriseres af metakromatiske farvestoffer, de give en variabel tone til de forskellige strukturer i overensstemmelse med belastningen af polyanioner, de besidder..
Det er sådan, at den strategiske kombination af basiske og sure farvestoffer er i stand til at udvikle et bredt spektrum af farver i henhold til de biokemiske egenskaber ved hver struktur, der går gennem lyseblå, mørkeblå, lilla og lilla toner i tilfælde af sure strukturer.
Mens farven fra eosin er mere stabil, genererer farver mellem rødlig-orange og laks.
materialer
Materialer til fremstilling af moderopløsningen
Forberedelsen af stamopløsningen kræver vejning af 600 mg pulveriseret Giemsa-farvestof, der måler 500 cc acetonfri methylalkohol og 50 cc neutral glycerin.
Forberedelsesmåde af moderopløsningen
Placer det tunge Giemsa pulver i en mørtel. Hvis der er klumper, skal de sprøjtes. Derefter tilsættes en mærkbar mængde af den målte glycerin og blandes meget godt. Den opnåede blanding hældes i en meget ren ravflaske.
Resten af glycerin er anbragt i mørtel. Bland igen for at rense det resterende farvestof, som har fastgjort til murens vægge og hæld i den samme flaske.
Flasken er dækket og båret i 2 timer i et vandbad ved 55ºC. Mens du er i et bain-marie-bad, rør let blandingen hver halve time eller deromkring.
Efterfølgende får blandingen lov at afkøle for at placere alkoholen. Tidligere er en del af den målte alkohol placeret i mørtelen for at afslutte vaskningen af det resterende farvestof, hvorefter det tilsættes til blandingen sammen med resten af alkoholen.
Dette præparat skal kunne modnes i mindst 2 uger. Den del, der anvendes af moderopløsningen, skal filtreres.
For at undgå forurening af præparatet anbefales det at passere den del, der bliver i konstant brug til en lille ravflaske med dråber. Genoplad hver gang reagenset løber ud.
Materialer til fremstilling af bufferopløsningen
På den anden side fremstilles en bufferopløsning ved pH 7,2 som følger:
6,77 gram natriumphosphat (vandfri) vejes (NaHPO4), 2,59 g kaliumdihydrogenphosphat (KH)2PO4) og destilleret vand op til 1000 cc.
Endelig fremstilling af farvestoffet
Til fremstilling af den endelige farvningsopløsning måles 2 cc af den filtrerede stamopløsning og blandes med 6 cc af bufferopløsningen. Blandingen omrøres.
En relevant kendsgerning, der skal tages i betragtning, er, at teknikkerne til fremstilling af farvestoffet kan ændres i overensstemmelse med det kommercielle hus.
Yderligere materialer er nødvendige for at udføre farvningen
Bortset fra de beskrevne materialer skal den være forsynet med farvebroer, vandskærme eller puffer til vask, plader til genstande eller dæk, stopur for at styre farvetiderne og blottpapiret eller noget materiale, der kan tørres ( gasbind eller bomuld).
teknik
Farvningsproces
1) Før farve skal du have prøvespredningen på et rent dias..
Prøverne kan være blod, knoglemarv, udskæringer af histologiske væv eller cervico-vaginale prøver. Det anbefales, at ydersiden er tynd og har 1 eller 2 timer tørring, før de farves.
2) Alle de ark, du skal farve, placeres på en farvet bro. Altid arbejde i samme rækkefølge og identificere hvert ark godt.
3) Placér et par dråber 100% methylalkohol (methanol) på smøret og lad det stå i 3 til 5 minutter for at fixere og dehydrere prøven.
4) Kassér den tilstedeværende methanol i arket og lad det lufttørre.
5) Når du er tør, læg den endelige farvningsløsning med en dråber, indtil hele pladen er dækket. Lad være i 15 minutter. Nogle forfattere anbefaler op til 25 min. Afhænger af det kommercielle hus.
6) Afløb farvestoffet og vask smøret med destilleret vand eller med 7,2 pufferopløsning.
7) På et blottpapir skal arkene tørre i fri luft, arrangeret lodret ved hjælp af en støtte.
8) Tør bagsiden af diaset af med en gasbind eller en vatpind fugtet med alkohol for at fjerne resterende farvestof.
Hjælpeprogrammer
Giemsa-farvningsteknikken anvendes på flere områder, herunder: hæmatologi, mykologi, bakteriologi, parasitologi, cytologi og cytogenetik.
hæmatologi
Det er det hyppigste værktøj, der gives til denne farvning. Med det kan vi identificere hver eneste af de celler, der findes i prøver af knoglemarv eller perifert blod. Udover at estimere antallet af hver serie, være i stand til at detektere leukocytose eller leukopeni, trombocytopeni mv..
Fordi det er følsomt for at identificere umodne celler, er det relevant ved diagnosticering af akutte eller kroniske leukæmier. Det er også muligt at diagnosticere anæmi, blandt andet sigcellesygdom, seglcelle sygdom..
mycology
På dette område er det almindeligt at bruge det til at søge efter Histoplasma capsulatum (intracellulær dimorf svamp) i vævsprøver.
bakteriologi
I hæmatologiske udstrygninger farvet med Giemsa er det muligt at detektere Borrelias sp hos patienter, der har sygdommen kaldt feber recurrentis. Spirocheter er rigelige blandt erythrocytter, i prøver taget ved febriltoppen.
Det er også muligt at visualisere intracellulære bakterier som Rickettsias sp og Chlamydia trachomatis i inficerede celler.
parasitologi
På området parasitologi har Giemsa-farvning muliggjort diagnose af parasitære sygdomme som malaria, chagas sygdom og leishmaniasis..
I de to første parasitterne Plasmodium sp og Trypanosoma cruzi henholdsvis de kan visualiseres i de perifere blod af de inficerede patienter, de kan findes i forskellige trin i henhold til den fase, hvor sygdommen er.
For at forbedre søgen efter blodsparasitter anbefales det at anvende Giemsa plet blandet med May-Grünwald farvestoffet.
Ligeledes kan kutan leishmaniasis diagnostiseres ved evaluering af prøver af hudbiopsier farvet med Giemsa, hvor parasitten er fundet.
cytologi
Giemsa-farvning anvendes også til den cytologiske undersøgelse af endocervikale prøver, selv om det ikke er den mest anvendte teknik til dette formål.
Men i tilfælde af mangel på ressourcer kan der anvendes en funktionalitet svarende til den, der tilbydes af Papanicolaou-teknikken og til en lavere pris. Det kræver dog ekspertise fra eksaminatorens side.
cytogenetik
Et relevant træk ved Giemsa-farvning er dets evne til at binde stærkt til områder med rigdom af DNA-adeniner og thyminer. Dette gør det muligt at visualisere DNA'et under mitos af cellerne i forskellige kondensationsforhold.
Disse undersøgelser er nødvendige for at detektere kromatiske aberrationer såsom duplikationer, deletioner eller translokationer af de forskellige regioner af kromosomerne..
Forskning, der viser virkningen af Giemsa-farvning
Cannova et al. (2016) sammenlignet 3 farvningsteknikker til diagnosticering af kutan leishmaniasis.
Til dette anvendte de prøver fra et forsøgsdyr (Mesocrisetus auratus) eksperimentelt podet med Leishmanias.
Forfatterne viste, at Giemsa-farvning var bedre end Pap-mart® og Gaffney-farvning. Derfor fandt de, at Giemsa pletten er ideel til at diagnosticere kutan leishmaniasis.
De fremragende resultater opnået ved forfatterne skyldes kombinationen af farvestoffer, der udgør blandingen af Giemsa præsenterer de nødvendige for at skabe et gunstigt kontrast forhold og giver klar sondring strukturer amastigoter både intra- og ekstracellulært.
De andre teknikker (Pap-mart® og Gaffney) gjorde det også, men på en svagere måde og derfor vanskeligere at visualisere. Derfor anbefales Giemsa-pletten til den parasitologiske diagnose af leishmaniasis.
Ligeledes kan en undersøgelse af Ramirez et al (1994) evaluerede gyldigheden af Giemsa og Lendrum i conjunctivale udstrygninger til identifikation Chlamydia trachomatis.
Forfatterne fastslog, at Giemsa og Ledrum-farvning har samme specificitet, men Giemsa var mere følsom.
Dette forklarer, hvorfor Giemsa-farvning for tiden er den hyppigste anvendte til diagnosticering af chlamydialinfektioner, især hvis der er få ressourcer.
Anbefalinger til god farvning
Tørringen af arkene bør ikke accelereres. Forsigtighedstiden skal ventes for at tørre den i fri luft. Ca. 2 timer.
Farve umiddelbart efter 2 timer for de bedste resultater.
For at smørefjernerne kan blive fastgjort og farves bedre, skal prøven fordeles på arket på en sådan måde, at et tyndt og ensartet lag forbliver.
Den foretrukne prøve er blod kapillær, som det smear sker direkte fra blodet drop og dermed prøven ikke bærer nogen additiv, der fremmer opretholdelsen af cellestrukturer.
Men hvis venøst blod anvendes, skal EDTA anvendes som antikoagulant og ikke heparin, da sidstnævnte deformerer cellerne sædvanligvis.
Almindelige fejl i farvningen af Giemsa
Ved udøvelsen af denne farve kan der laves fejl. De fremgår af pludselige ændringer i strukturenes skygger.
Ekstremt blå farve
Det kan skyldes:
- Meget tykke udsmykninger
- Overskrider farvningstiden
- For lidt vask.
- Anvendelse af reagenser godt over neutral pH (alkalisk).
Under disse betingelser farverne på de følgende strukturer er forvrænget, så erytrocytter snarere end farvet pink-laks er grøn, vil granulatet af eosinofiler, der bør farves røde mursten blålig eller grå tænder og så videre vilje afvigelse i de sædvanlige tonaliteter.
Overdreven pink farve
Det kan skyldes:
- Utilstrækkelig farvningstid.
- Langvarig eller overdreven vask.
- Dårlig tørring.
- Anvendelse af meget sure reagenser.
I dette særlige tilfælde vil de strukturer, der normalt er farvede blå, ikke være næsten synlige, mens de strukturer, der er farvede pink vil have meget overdrevne tonaliteter.
Eksempel: erythrocytter tage et stærkt klar rød eller orange farve, vil nukleare chromatin lyserød og granuler af eosinofiler farves lys rød intens.
Tilstedeværelse af bundfald i smøret
Årsagerne kan være:
- Brug snavset eller dårligt vasket ark.
- Lad ikke smøret tørre godt.
- Lad løsningsopløsningen være for lang.
- Utilstrækkelig vask i slutningen af farvning.
- Utilstrækkelig filtrering eller ikke-filtrering af farvestoffet, der anvendes.
Tilstedeværelse af morfologiske artefakter
Morfologiske artefakter kan forekomme i udstrygningerne, hvilket gør det vanskeligt at visualisere og fortolke de tilstede strukturer. Dette skyldes:
- Type antikoagulant anvendt, såsom heparin.
- Brug af beskidte, beskadigede eller fedtede plader.
Opbevaringstilstand
Efter tilberedning bør farvestoffet opbevares ved stuetemperatur (15-25 ° C) for at forhindre, at farvestoffet falder ud. Det skal opbevares i en lukket gule beholder.
referencer
- Cannova D, Brito E og Simons M. Evaluering af farvningsteknikker til diagnosticering af kutan leishmaniasis. Salus. 2016 20 (2): 24-29.
- PanReac Applichem ITW Reagenser. Giemsa plet. Version 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Spanien.
- Clark G. Staining Procedures (1981), 4th. Williams & Willkins.
- Anvendt klinisk kemi Giemsa farve til diagnose in vitro. Distributør: cromakit.es
- Ramirez R, Mejia M, Garcia de la Riva J, F og Hermes Grazioso C. gyldighed Giemsa og Lendrum i konjunktivale podninger til identifikation Chlamydia trachomatis. Bolle af Sanit Panam. 1994; 116 (3): 212-216.
- Casas-Rincon G. General Mycology. 1994. 2. udgave Universidad Central de Venezuela, Bibliotek udgaver. Venezuela, Caracas.
- "Giemsa plet." Wikipedia, Den frie encyklopædi. 1 sep 2017, 01:02 UTC. 6 dec 2018, en.wikipedia.org.


