Kinyoun farvning fundament og teknikker
den Kinyoun farvning Det er en farvningsteknik brugt til at plette syrefaste bakterier og syreparasitter. Det blev født af modifikationen af Ziehl-Neelsens farve. Begge teknikker tolkes på samme måde, men de adskiller sig i to elementer: i fremstillingen af hovedreagenset, og at Kinyoun-teknikken ikke bruger varme.
Af denne grund er det også kendt som kold-modificeret Ziehl-Neelsen eller Kinyoun koldfarvning. Det er angivet til farvning af Mycobacterium tuberculosis, Mycobacterium leprae, atypiske mykobakterier, Nocardias sp, Cryptosporidium parvum, Cryptosporidium meleagridis, Cryptosporidium felis, Cryptosporidium muris og Cyclosporas cayetanensis.
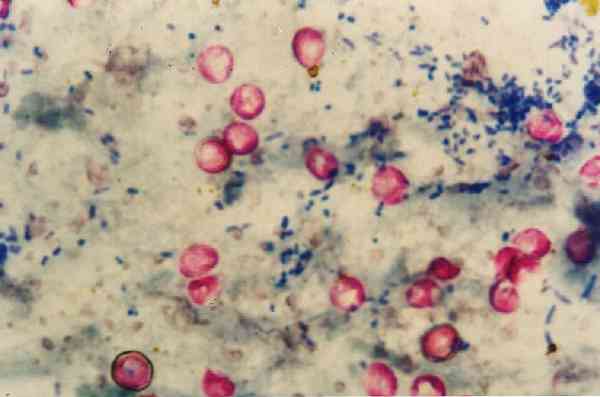
Det er værd at nævne, at Nocardias pletter svagt med denne teknik, da de er delvist syrefast aluminium, så for denne genre er der en ændring af metoden.
Til gengæld blev Kinyoun-koldteknikken kombineret med trichrometeknikken modificeret af Didier til påvisning af coccidia (Cryptosporidium parvum og Isospora belli) og spor af mikrosporidier (Enterocytozoon bieneusi og Encephalitozoon intestinalis).
indeks
- 1 Foundation
- 2 Teknik
- 2.1 Materialer
- 2.2 Fremstilling af Kinyoun-fenikeret fuchsin
- 2.3 Fremstilling af alkohol-syre
- 2.4 Fremstilling af methylenblåt kontrastfarvestof
- 2,5 Kinyoun-farvningsteknik
- 2.6 Special Kinyoun teknik til nocardier
- 2.7 Kombineret teknik af phenol og trichromic fuchsin modificeret af Didier
- 2.8 Kvalitetskontrol
- 3 Kinyoun teknik sammenlignet med Ziehl teknikken -Neelsen
- 4 Reference
fundament
Den primære reagens er carbolfuchsin farvning eller fuchsin, som har den egenskab at binde til eksisterende carbololie syrer inden for cellevæggen voksagtigt lipidmateriale rige (mycolsyrer) af Mycobacteria og visse parasitter.
Denne union er ikke modvirket af syreaffarvning; Derfor er mikroorganismer defineret som syrefast alkohol.
Modsætning til Ziehl-Neelsen teknik som fikserer farvestoffet gennem varme-, i teknikken Kinyoun dette trin ikke nødvendigt, da løsningen fuchsin forberede denne teknik indeholder høj koncentration af phenol.
Phenol opløser lipidmaterialet i cellevæggen, hvilket tillader indtræden af carbol fuchsinfarvestoffet. Når farvestoffet trænger ind, forbliver det fast, trods vask med alkohol-syre.
På denne måde overtager de syrefaste mikroorganismer den karakteristiske røde farve, mens alt, hvad der ikke er syrefast alkohol, bliver misfarvet og farvet blå..
teknik
materialer
- Modificeret phenol fuchsin.
- Alkohol edd.
- Methylenblå.
Fremstilling af Kinyoun-fenikeret fuchsin
- Grundlæggende fuchsin: 4 gr.
- Phenol: 8 ml.
- Alkohol (95%): 20 ml.
- Destilleret vand: 100 ml.
Den grundlæggende fuchsin i alkohol skal opløses langsomt og blandes konstant. Derefter smelter den krystalliserede phenol i et vandbad ved 56 ° C. Efter opløsning tilsættes 8 ml til den ovenfor fremstillede fuchsinopløsning.
Fremstilling af alkohol-syre
- Koncentreret saltsyre: 3 ml.
- Ethanol (95%): 97 ml.
Det skal måles, sammenføjes og blandes.
Fremstilling af methylenblåt kontrastfarvestof
- Methylenblå: 0,3 g.
- Destilleret vand: 100 ml.
Det vejes og opløses.
Kinyoun-farvningsteknik
1- Forbered et smear direkte fra prøven, som kan være sputum, lungevæske, urinsediment, cerebrospinalvæske eller fæces, blandt andre; eller fra en suspension af mikroorganismer opnået fra rene kolonier udviklet i primærkulturmedier.
2- Fastgør smøret med varme.
3- Placer smøret på farvebroen og dækk med Kinyouns phenol-fuchsinreagens tilberedt. Lad det sidde i 3 eller 5 minutter.
4- Vask med destilleret vand.
5- Bleach med syrealkohol i 3 minutter og vask igen med destilleret vand.
6- Blegemiddel igen med sur alkohol i 1 eller 2 minutter, indtil der ikke trækkes mere farvestof.
7- Vask med destilleret vand og lad afløb, og placer glideren i opretstående stilling.
8- Dæk præparatet med methylenblåt og lad det stå i 4 minutter.
9 - Vask med destilleret vand og lad luft tørre.
10- Undersøg ved 40X og derefter ved 100X.
Hvis du ønsker forbedrede og fremskyndes farvning syre alkohol resistente mikroorganismer, tilsættes en dråbe af et befugtningsmiddel (såsom Tergitol No. 7) en 30 eller 40 ml Fuchsin Kinyoun.
Nogle laboratorier ændrer methylenblåt kontrastfarvestof til lysegrøn eller picrinsyre; den første giver en grøn farve til baggrunden, og den anden genererer en gul farve.
Kinyoun teknik speciel til Nocardias
For at forbedre farvningen af Nocardia-bakterier anvendes en modifikation af Kinyoun-farvning. Teknikken er som følger:
1- Dæk smøret med Kinyoun fenikeret fuchsin i 3 minutter.
2- Vask med destilleret vand.
3- Blegemiddel med 3% tilberedt syrealkohol, indtil der ikke længere er farvestof.
4- Vask igen med destilleret vand.
5- Dæk præparatet med methylenblåt og lad det stå i 30 sekunder.
6- Vask med destilleret vand og lad luft tørre.
Kombineret teknik af phenol og trichromic fuchsin modificeret af Didier
Denne teknik anbefales til analyse af afføring prøver på jagt efter coccidia og sporer af Microsporidium sp på samme tid Den procedure, der skal følges, er som følger:
1- Dæk smøret med Kinyoun phenol fuchsin i 10 minutter.
2- Fjern farvestoffet og vask med destilleret vand.
3- Bleach i 30 sekunder med alkohol saltsyre.
4- Vask igen med destilleret vand.
5- Dæk smødet med trichromopløsning i 30 minutter ved 37 ° C.
6- Vask med destilleret vand.
7- Decolorize i 10 sekunder med alkoholeddikesyre.
8- Vask smøret i 30 sekunder med 95% ethanol.
Kvalitetskontrol
Som en positiv kontrol fremstilles udstrygninger med stammer af Mycobacterium tuberculosis og farves med de fremstillede reagenser for at verificere, at bakterierne tager den rigtige farve (rødfuksi).
Negative kontroller kan også bruges ved at forberede smør med en hvilken som helst stamme, der ikke er syreresistent alkohol, hvilket bekræfter, at hele prøven tager kontrastfarven.
Kinyoun teknik sammenlignet med Ziehl teknikken -Neelsen
Kinyoun teknik er enklere, fordi det eliminerer trinnet med opvarmning, men dens største fordel er, at den undgår afgivelse af dampe, yderst giftige og forårsager langvarig kræft. Derfor er Kinyoun-farvning sikrere for farvningspersonale.
Det er vigtigt at tage højde for, at det er nødvendigt at passe på, at reagenserne ikke kommer i direkte kontakt med huden, da de er ætsende og blegemiddelet er brændbart.
Med hensyn til ulemperne indikerer et negativt smør ikke nødvendigvis, at mikroorganismen ikke er til stede. Derudover kan tilstedeværelsen af celledetritus forårsage falske positive, hvilket skaber forvirring i diagnosen.
henvisning
- Anvendt klinisk kemi (2016). BK Kinyoun Kit. Tilgængelig på: cromakit.es
- Orozco-Rico Miguel. Kinyoun plet og to kakcidier i HIV. Medical Journal MD. 2011; 3 (2): 137
- Forbes B, Sahm D, Weissfeld A (2009). Mikrobiologisk diagnose af Bailey & Scott. 12 udg. Argentina. Panamericana S.A Editorial.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. (5. udgave). Argentina, Editorial Panamericana S.A..
- Wikipedia bidragsydere. "Kinyoun plet." Wikipedia, den frie encyklopædi. Wikipedia, den frie encyklopædi, 8. februar 2018. Web. 5. januar 2019.
- Combol A, Fernández N, Figueredo E, cradling Zanetta E. Gennemførelse af en farvning teknik til samtidig diagnose af coccidier og Microsporidia. Institut for Hygiejne ved Republikken Universitet. Montevideo. Uruguay. Tilgængelig på: higiene.edu.uy


