Ziehl-Neelsen Stain Foundation, Reagenser og Teknik
den Ziehl-Neelsen plet i en farvningsteknik til identificering af alkohol-resistente mikroorganismer (AAR). Navnet på denne mikrobiologiske procedure refererer til dets forfattere: bakteriologen Franz Ziehl og patologen Friedrich Neelsen.
Denne teknik er en type differentieret farve, hvilket indebærer brugen af forskellige farvestoffer for at skabe kontrast mellem de strukturer, som du vil observere, differentiere og senere identificere. Ziehl-Neelsen plet anvendes til at identificere bestemte typer mikroorganismer.
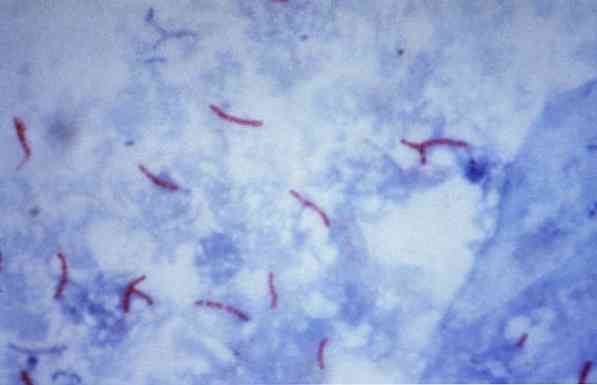
Nogle af disse mikroorganismer er mykobakterier (for eksempel, Mycobacterium tuberculosis), nocardier (for eksempel, Nocardia sp.) og nogle unicellulære parasitter (for eksempel, Cryptosporidium parvum). Mange af bakterierne kan klassificeres ved hjælp af en fælles teknik kaldet Gram stain.
Men nogle bakteriegrupper kræver andre metoder til at identificere dem. Teknikker som Ziehl-Neelsen-farvning kræver kombinationer af farvestoffer med varme for at fastgøre den første til cellevæggen.
Derefter kommer en misfarvningsproces, der giver to resultater: modstand eller følsomhed overfor misfarvning af syrer og alkoholer.
indeks
- 1 Foundation
- 1.1 Sekundær farvning
- 2 reagenser
- 2.1 Primær farvning
- 2.2 Affarvende opløsning
- 2.3 Sekundær farvning (anti-farvestof)
- 3 Teknik
- 3.1 Acid-hurtig farvningsprocedure
- 4 referencer
fundament
Grundlaget for denne farvningsteknik er baseret på disse mikroorganismers cellevægegenskaber. Væggen er dannet af en type fedtsyrer kaldet mycolic syrer; Disse karakteriseres af meget lange kæder.
Når fedtsyrer har meget lange strukturer, kan de lettere opretholde farvestoffer. Nogle genera af bakterier er meget vanskelige at plette ved Gram-plet på grund af den høje mykolsyreindhold i cellevæggen.
I Ziehl-Neelsen-pletten anvendes den phenoliske forbindelse carbol fuchsin, et basisfarvestof. Dette har evnen til at interagere med cellevæggens fedtsyrer, hvilket er voksagtig tekstur ved stuetemperatur.
Carbol fuchsin farvning forbedres i nærvær af varme, fordi voks smelter og farvestofmolekylerne bevæger sig hurtigere ind i cellevæggen.
Syren, som anvendes senere, tjener til at misfarve cellerne, der ikke blev farvet, fordi deres væg ikke var tilstrækkeligt relateret til farvestoffet; Derfor er styrken af syredekolorisatoren i stand til at fjerne syrefarvestoffet. De celler, der modstår denne misfarvning, kaldes syrefast.
Sekundær farvning
Efter affarvningen af prøven modsiges dette med et andet farvestof kaldet sekundært farvestof. Methylenblå eller malachitgrøn anvendes generelt.
Det sekundære farvestof pletter baggrundsmaterialet og skaber følgelig kontrast til de strukturer, der blev farvet i det første trin. Kun de misfarvede celler absorberer det andet farvestof (anti-plet) og tager deres farve, mens de syrefaste celler bevarer den røde farve.
Denne procedure anvendes ofte til identifikation af Mycobacterium tuberculosis og Mycobacterium leprae, som kaldes syrefaste baciller.
reagenser
Primærfarvning
Carboxin 0,3% fuchsin (filtreret) anvendes. Dette farvestof fremstilles ud fra en blanding af alkoholer: phenol i ethanol (90%) eller methanol (95%), og i denne blanding opløses 3 gram basisk fuchsin.
Dekoloriserende opløsning
I dette trin kan du bruge opløsninger af 3% alkoholsyre eller 25% svovlsyre.
Sekundær farvning (anti-farvestof)
Farvestoffet, der oftest bruges til at udføre kontrast i prøverne, er normalt 0,3% methylenblåt. Imidlertid kan andre også anvendes, såsom 0,5% malachitgrøn.
teknik
Acid-hurtig farvningsprocedure
Forbered en bakteriel smear
Dette præparat fremstilles på et rent og tørt objektglas efter sterilitetsforanstaltninger.
Tørre smøret
Lad smøret tørre ved stuetemperatur.
Varm prøven
Prøven skal opvarmes ved at anvende ild til lysbilledet nedenfor. En fiksering med alkohol kan gøres, når smøret ikke er blevet tilberedt med sputum (behandlet med natriumhypochlorit for at bløde det), og hvis det ikke vil blive farvet umiddelbart..
M. tuberculosis Det elimineres med blegemiddel og under farvningsprocessen. Termofixering af ubehandlet sputum dræber ikke M. tuberculosis, mens fiksering med alkohol er bakteriedræbende.
Dæk pletten
Pletten er dækket af carbol fuchsin-opløsningen (primær grundfarve).
Varm pletten
Dette gøres i 5 minutter. Du bør bemærke en dampafgivelse (ca. 60 ° C). Det er vigtigt ikke at overophede og undgå at brænde prøven.
Med hensyn til opvarmning af pletten skal der tages stor omhu ved opvarmning af fuchsincarbol, især hvis farvningen udføres på en bakke eller anden beholder, hvor meget brandfarlige kemikalier er blevet opsamlet fra den forrige plet.
Kun en lille flamme bør anbringes under gliderne ved hjælp af en tændt vatpind, der tidligere er fugtet med et par dråber syrealkohol, methanol eller 70% ethanol. Undgå at bruge en stor vatpinde gennemblødt i ethanol, da dette er en brandfare.
Vask pletten
Denne vask skal udføres med rent vand. Hvis vandet ikke er rent, vaskes smøret med filtreret eller destilleret vand, helst.
Dæk smøret med syrealkohol
Denne sure alkohol bør være på 3%. Dækningen udføres i 5 minutter eller indtil smøret er tilstrækkeligt misfarvet, det vil sige lyserødt.
Det skal tages i betragtning, at syrealkohol er brandfarlig; Derfor skal det bruges meget omhyggeligt. Undgå at være tætte antændelseskilder.
Vask pletten
Vaskningen skal være med rent, destilleret vand.
Dæk smødet med farvestof
Det kan være grøn malakit (0,5%) eller methylenblåt (0,3%) farvestof i 1 eller 2 minutter, med den længste tid, hvis smøret er tyndt.
Vask pletten
Rent vand skal bruges igen (destilleret).
dræne
Rygets bagside skal rengøres, og pletten skal anbringes på en afløbshylde, så den er lufttørret (brug ikke absorberende papir til tørring).
Undersøg smeden i mikroskopet
100X-målet og nedsænkningsolien skal anvendes. Scan smøret systematisk og skriv ned de relevante observationer.
Fortolk resultaterne
Teoretisk betragtes mikroorganismer, der er farvet en rødlig farve, som syrefaste positive (AAR +).
Tværtimod, hvis mikroorganismerne farves blåt eller grønt, afhængigt af farvestoffet, der anvendes som modfarvestof, betragtes de som negative alkoholresistente syre (AAR-).
referencer
- Apurba, S. & Sandhya, B. (2016). Essentials of Practical Microbiology (1. udgave). Jaypee Brothers Medical Publishers.
- Bauman, R. (2014). Mikrobiologi med sygdomme ved kropssystem (4. udgave). Pearson Education, Inc.
- Heritage, J., Evans, E. & Killington, A. (1996). Indledende mikrobiologi (1. udgave). Cambridge University Press.
- Morello, J., Granato, P. Wilson, M. & Morton, V. (2006). Laboratoriehåndbog og arbejdsbog i mikrobiologi: Ansøgninger til patientpleje (11. udgave). McGraw-Hill Education.
- Vasanthakumari, R. (2007). Lærebog om mikrobiologi (1. udgave). B.I. Publikationer PVT.


