Organiske salte fysiske og kemiske egenskaber, anvendelser og eksempler
den organiske salte de er et tæt antal ionforbindelser med utallige egenskaber. De hidrører tidligere fra en organisk forbindelse, som har gennemgået en transformation, der tillader det at være en bærer af en ladning, og at dets kemiske identitet også afhænger af den tilhørende ion.
På billedet nedenfor er der vist to meget generelle kemiske formler for organiske salte. Den første, R-AX, fortolkes som en forbindelse i hvis carbonstruktur et atom eller gruppe A bærer en positiv ladning + eller negativ (-).
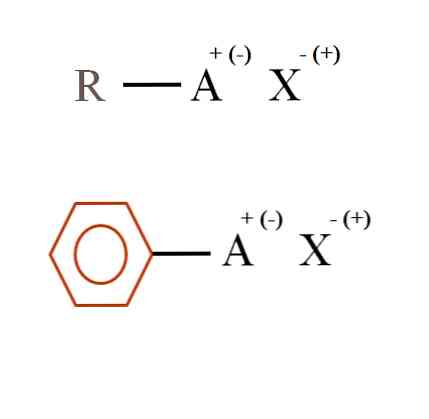
Som vist er der er en covalent binding mellem R og A, R-A, men til gengæld A har en formel ladning, som tiltrækker (eller frastøder) ion X. Tegnet af ladningen afhænger af beskaffenheden af A og det kemiske miljø.
Hvis A var positiv, hvor mange X kunne det interagere med? Med kun én, der er givet princippet om elektroneutralitet (+ 1-1 = 0). Men hvad er identiteten af X? Anionen X kunne være CO32-, der kræver to kationer RA+; et halogenid: F-, cl-, br-, etc .; eller endda en anden RA-forbindelse-. Indstillingerne kan ikke beregnes.
Et organisk salt kan også have en aromatisk karakter, illustreret i den brune benzenring. Kobberbenzoatsaltet (II), (C6H5COO)2Cu består for eksempel af to aromatiske ringe med negativt ladede carboxylgrupper, som interagerer med Cu-kationen.2+.
indeks
- 1 Fysiske og kemiske egenskaber
- 1.1 Højmolekylære masser
- 1.2 Amphiphiles og overfladeaktive stoffer
- 1.3 Højkogende eller smeltepunkter
- 1.4 surhed og basicitet
- 2 anvendelser
- 3 Eksempler på organiske salte
- 3.1 carboxylater
- 3.2 lithiumdiacryluprater
- 3.3 Salte af sulfonium
- 3.4 Salte af oxonium
- 3,5 aminsalte
- 3,6 diazoniumsalte
- 4 referencer
Fysiske og kemiske egenskaber
Billede kan det siges, at de organiske salte består af tre komponenter: den organiske, R eller Ar (den aromatiske ring), et atom eller ion ladningsbærer En gruppe, og en modion X.
Ligesom kemiske identitet og struktur er defineret af sådanne komponenter, så deres egenskaber afhænger af dem.
Fra denne kendsgerning kan opsummeres visse generelle egenskaber, der opfylder langt de fleste af disse salte.
Højmolekylære masser
Under antagelse af mono- eller polyvalente uorganiske X-anioner har organiske salte sædvanligvis meget større molekylmasser end uorganiske salte. Dette skyldes hovedsageligt carbonskeletet, hvis enkle C-C-bindinger og deres hydrogenatomer bidrager meget masse til forbindelsen.
Derfor er de R eller Ar ansvarlige for deres højmolekylære vægte.
Amfifiler og overfladeaktive stoffer
Organiske salte er amfifile forbindelser, det vil sige, deres strukturer har både hydrofile og hydrofobe ender.
Hvad er sådanne ekstremer? R eller Ar repræsenterer den hydrofobe ende, fordi deres C- og H-atomer ikke har stor affinitet for vandmolekyler.
En+(-), Atomet eller gruppen, der bærer ladningen, er den hydrofile ende, da den bidrager til det dipolære øjeblik og interagerer med de vanddannende dipoler (RA+ OH2).
Når de hydrofile og hydrofobe regioner polariseres, bliver det amfifile salt et overfladeaktivt middel, et stof, der i vid udstrækning anvendes til fremstilling af detergenter og demulgatorer.
Højkogende eller smeltepunkter
Ligesom uorganiske salte har organiske salte også højtsmeltende og kogepunkter på grund af de elektrostatiske kræfter, der styrer i flydende eller fast fase.
Imidlertid har en organisk komponent R eller Ar andre typer af Van der Waals-styrker (London-styrker, dipol-dipol, brintbroer), der konkurrerer på en vis måde med elektrostatiske.
Af denne grund er de faste eller flydende strukturer af de organiske salte i første omgang mere komplekse og varierede. Nogle af dem kan endda opføre sig som flydende krystaller.
Surhed og basicitet
Organiske salte er sædvanligvis stærkere syrer eller baser end uorganiske salte. Dette skyldes, at A, for eksempel i aminsaltene, har en positiv ladning på grund af sin binding med et yderligere hydrogen: A+-H. Derefter, i kontakt med en base, donere protonen for at vende tilbage til at være en neutral forbindelse:
RA+H + B => RA + HB
H tilhører A, men den er skrevet som den intervenerer i neutraliseringsreaktionen.
På den anden side er RA+ det kan være et stort molekyle, der ikke er i stand til at danne faste stoffer med et krystallinsk netværk, der er tilstrækkeligt stabilt med hydroxylanionen eller hydroxylOH-.
Når dette er tilfældet, salt RA+OH- det opfører sig som en stærk base; lige så grundlæggende som NaOH eller KOH:
RA+OH- + HCI => RACl + H2O
Bemærk i den kemiske ligning, at Cl anionen- det erstatter OH-, danner salt RA+cl-.
applikationer
Anvendelsen af organiske salte vil variere i overensstemmelse med identiteten af R, Ar, A og X. Desuden afhænger applikationen, hvortil de er bestemt, også af typen af fast stof eller væske de danner. Nogle generelle forhold i denne henseende er:
-De tjener som reagenser til syntese af andre organiske forbindelser. RAX kan fungere som en "donor" af R-kæden, der skal tilsættes til en anden forbindelse, der erstatter en god udgående gruppe.
-De er overfladeaktive midler, så de kan også bruges som smøremidler. Metalsalte af carboxylater anvendes til dette formål.
-De giver mulighed for at syntetisere en bred vifte af farvestoffer.
Eksempler på organiske salte
carboxylater
Carboxylsyrerne reagerer med et hydroxid i en neutraliseringsreaktion, hvilket giver anledning til salte af carboxylater: RCOO- M+; hvor M+ Det kan være enhver metalkation (Na+, Pb2+, K+, etc.) eller NH ammoniumkationen4+.
Fedtsyrer er langkædede, alifatiske carboxylsyrer, de kan være mættede og umættede. Palmitinsyre (CH) er blandt de mættede3(CH2)14COOH). Dette stammer fra palmitatsalt, medens stearinsyre (CH3(CH2)16COOH danner stearatsaltet. Sæberne består af disse salte.
I tilfælde af benzoesyre, C6H5COOH (hvor C6H5- det er en benzenring), når det reagerer med en base danner benzoatsaltene. I alle carboxylater er -COO-gruppen- repræsenterer A (RAX).
Lithium diacupuprates
Litiumdiacuprat er nyttigt ved organisk syntese. Dens formel er [R-Cu-R]-Li+, hvor kobberatomet bærer en negativ ladning. Her repræsenterer kobber atomets atom A.
Sulfoniumsalte
De dannes ud fra omsætningen af et organisk sulfid med et alkylhalogenid:
R2S + R'X => R2R'S+X
For disse salte bærer svovlatomet en positiv formel ladning (S+) har tre kovalente bindinger.
Oxoniumsalte
Også etherne (de oxygenerede analoger af sulfiderne) reagerer med hydrociderne for at danne oxoniumsalte:
ROR '+ HBr <=> RO+HR '+ Br-
HBr protonsyre er kovalent bundet til den etheroxygenatom (R2O+-H), læser det positivt.
Aminsalte
Aminerne kan være primære, sekundære, tertiære eller kvaternære såvel som deres salte. Alle er kendetegnet ved at have et H-atom forbundet med nitrogenatomet.
Så, RNH3+X- det er et primært aminsalt; R2NH2+X-, af sekundær amin; R3NH+X-, tertiær amin; og R4N+X-, af kvaternær amin (kvaternært ammoniumsalt).
Diazoniumsalte
Endelig er diazoniumsalte (RN2+X-) eller arildiazonium (ArN)2+X-), Repræsenterer udgangspunktet for mange organiske forbindelser, især azofarvestoffer.
referencer
- Francis A. Carey. Organisk kemi (Sjette udgave., P 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organisk kemi. Aminer. (10. udgave.). Wiley Plus.
- Wikipedia. (2018). Salt (kemi). Hentet fra: en.wikipedia.org
- Steven A. Hardinger. (2017). Illustreret ordliste for organisk kemi: salte. Hentet fra: chem.ucla.edu
- Chevron Oronite. (2011). Carboxylater. [PDF]. Hentet fra: oronite.com


