Aluminiumsulfid (Al2S3) Kemisk struktur, Nomenklatur, Egenskaber
den aluminiumsulfid (Al2S3) Det er en kemisk forbindelse lysegråt dannet ved oxidationen af aluminiummetal til at miste elektroner sidste energiniveau og bliver kation, og ved at reducere ikke-metalliske svovl, vinde elektronerne givet af aluminium og blive en anion.
For at dette kan ske, og aluminiumet kan give sine elektroner, er det nødvendigt at præsentere tre hybrid orbitale sp3, der giver mulighed for at danne bindinger med elektroner fra svovl.

Følsomheden af aluminium sulfid til vand betyder, at i nærvær af vanddamp i luften, kan reagere producerende aluminiumhydroxid (AI (OH)3), hydrogensulfid (H2S) og hydrogen (H2) Gas; hvis sidstnævnte ophobes, kan det forårsage en eksplosion. Derfor bør emballagen af aluminiumsulfid fremstilles ved hjælp af lufttætte beholdere.
På den anden side, da aluminiumsulfid har reaktivitet med vand, gør dette det til et element, der ikke har nogen opløselighed i opløsningsmidlet.
indeks
- 1 Kemisk struktur
- 1.1 Molekylformel
- 1.2 Strukturformel
- 2 Egenskaber
- 2.1 Fysiske egenskaber
- 2.2 Kemiske egenskaber
- 3 anvendelser og applikationer
- 3.1 I superkapacitorer
- 3.2 I sekundære lithium batterier
- 4 risici
- 4.1 Førstehjælpsprocedure
- 4.2 Brandbekæmpelse
- 5 referencer
Kemisk struktur
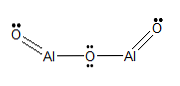
Molekylformel
til2S3
Strukturel formel
- Aluminiumsulfid.
- Di aluminium trisulfid.
- Aluminiumsulfid (III).
- Aluminiumsulfid.
egenskaber
Kemiske forbindelser udviser hovedsagelig to slags egenskaber: fysisk og kemisk.
Fysiske egenskaber
Molær masse
150.158 g / mol
tæthed
2,02 g / ml
Smeltepunkt
1100 ° C
Vandopløselighed
uløselige
Kemiske egenskaber
En af hovedreaktionerne af aluminiumsulfid er med vand som substrat eller hovedreagens:

Denne reaktion kan observeres dannelsen af aluminiumhydroxid og hydrogensulfid hvis den er i gasform, eller hvis hydrogensulfid opløses i vand som en opløsning. Dens tilstedeværelse er identificeret ved lugten af rådne æg.
Anvendelser og applikationer
I superkapacitorer
Aluminium sulfid anvendes til fremstilling af nanostrukturer net, der forbedrer specifikke overfladeareal og elektrisk ledningsevne, således at der opnås høj kapacitet og energitæthed, som er anvendeligheden af superkapacitanser.
Grafenoxid (GO) - grafen er en af de allotrope former for kulstof - har tjent som støtte til aluminiumsulfid (Al2S3) med en hierarkisk morfologi svarende til den af nano-montana fremstillet ved anvendelse af den hydrotermiske metode.
Grafenoxid virkning
Karakteristikaet for grafenoxid som bærer samt den høje elektriske ledningsevne og overfladearealet gør nanorambutanten Al2S3 være elektrokemisk aktiv.
CV-specifikke kapacitanskurver med veldefinerede redox toppe bekræfter nanorambutans Al pseudokapacitiv adfærd Al2S3 hierarkisk, vedvarende i grafenoxid i 1 M NaOH-elektrolyt. De specifikke CV-kapacitansværdier opnået fra kurverne er: 168,97 ved scanningshastigheden på 5mV / s.
Derudover er der observeret en god galvanostatisk udladningstid på 903 μs, en stor specifik kapacitans på 2178,16 ved den aktuelle densitet på 3 mA / cm2. Energitætheden beregnet ved galvanostatisk udledning er 108,91 Wh / kg, ved den aktuelle densitet på 3 mA / cm2.
Elektrokemisk impedans bekræfter således den pseudokapacitive karakter af den hierarkiske nano-hummingelektrode Al2S3. Elektrode stabilitetstesten viser en 57,44% tilbageholdelse af den specifikke kapacitans på op til 1000 cyklusser.
De eksperimentelle resultater tyder på, at nanorambutanten Al2S3 Hierarkisk er egnet til supercapacitor applikationer.
I sekundære lithium batterier
Med det formål at udvikle et lithium sekundært batteri med høj energi tæthed, aluminiumsulfidet (Al2S3) som aktivt materiale.
Den oprindelige udledningskapacitet målt fra Al2S3 var ca. 1170 mAh g-1 ved 100 mA g-1. Dette svarer til 62% af den teoretiske kapacitet for svovl.
Alen2S3 udvist en dårlig kapacitetsretention i det potentielle område mellem 0,01 V og 2,0 V, hovedsagelig på grund af den strukturelle irreversibilitet af ladingsprocessen eller Li-ekstraktion..
XRD- og K-XANES-analyserne for aluminium og svovl indikerede, at overfladen af Al2S3 reagerer reversibelt under lastnings- og losningsprocesserne, mens Al-kernen2S3 viste strukturelle irreversibilitet, fordi LiAl og Li2S blev dannet fra Al2S3 i den oprindelige download og derefter forblev de som de var.
risici
- Ved kontakt med vand frigives brandfarlige gasser, som kan spontant forbrænde.
- Forårsager hudirritation.
- Forårsager alvorlig øjenirritation.
- Kan forårsage irritation af åndedrætsorganerne.
Oplysningerne kan variere mellem meddelelser afhængigt af urenheder, tilsætningsstoffer og andre faktorer.
Førstehjælpsprocedure
Generel behandling
Søg lægehjælp, hvis symptomerne vedvarer.
Særlig behandling
none
Vigtige symptomer
none
inhalation
Tag offeret udendørs. Tilfør ilt hvis åndedræt er svært.
indtagelse
Administrer et eller to glas vand og fremkalder opkastning. Fremkald aldrig opkastning eller give noget til munden til en bevidstløs person.
hud
Vask det berørte område med vand og mild sæbe. Fjern forurenet tøj.
øjne
Vask dine øjne med vand, blinker ofte i flere minutter. Fjern kontaktlinser, hvis de er til stede, og fortsæt skylning.
Brandbekæmpelse
antændelighed
Ikke brandfarlig.
Slukningsmidler
Reagerer med vand. Brug ikke vand: Brug CO2, sand og slukningspulver.
Bekæmpelsesprocedure
Brug et fuldt selvstændigt åndedrætsværn med fuld beskyttelse. Brug tøj for at undgå kontakt med hud og øjne.
referencer
- Salud y Riesgos.com, (s.f), Definition, begreber og artikler om sundhed, risici og miljø. Gendannet: saludyriesgos.com
- Aluminiumsulfid. (S.f). På Wikiwand. Hentet den 9. marts 2018: wikiwand.com
- Webelementer. (S.f) .Dialuminium Trisulpfide, genfundet den 10. marts 2018: webelements.com
- Iqbal, M., Hassan, M., M., Bibi S., Parveen, B. (2017). High Specific Capacitance and Energy density af syntetiseret grafenoxidbaseret hierarkisk Al2S3 Nanorambutan til Supercapacitor Application, Electrochimica Acta, Bind 246 ,Sider 1097-1103
- Senoh, H., Takeuchi, T., Hiroyuki K., Sakaebe, H., M., Nakanishi, K., Ohta, T., Sakai, T., Yasuda, K. (2010). Elektrokemiske egenskaber ved aluminiumsulfid til brug i lithium.Journal of Power Kilder,Bind 195, Udgave 24, Sider 8327-8330 doi.org
- LTS Research Laboratories, Inc. (2016), sikkerhedsdatablad Aluminiumsulfid: ltschem.com