Kobbersulfidegenskaber, risici og anvendelser
den kobbersulfider Beskriv en familie af kemiske forbindelser og mineraler med formlen CuxSog. Disse forbindelser omfatter økonomisk vigtige mineraler og syntetiske materialer.
De mest fremtrædende kobbersulfidmineraler omfatter kobbersulfid (I) eller kobber sulfid med kemisk formel.2S, der findes i mineralsk calcosin og kobbersulfid (II) eller kobbersulfid, med CuS-formel fundet i covelitmineralet.
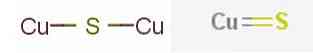
Calcosine er blevet ekstraheret i århundreder og er en af de mest rentable kobbermalmer. Årsagerne skyldes det høje kobberindhold (atomforhold på 67% og næsten 80 vægt%) og den lethed, hvormed kobber kan adskilles fra svovl.
Det er dog ikke det vigtigste kobbermineral på grund af dets knaphed. Selvom de rigeste calcosinaflejringer er blevet udvundet, bliver det sandsynligvis stadig mined og vil bestemt blive udvundet i fremtiden (MINERAL CHALCOCITE, 2014).

Covelite er ikke et distribueret mineral, men dets iriserende charme kan fange beundring af enhver, der ser indigo blå krystaller. Selvom gode krystaller er sjældne, er det glans og farve af dette mineral, der gør det bemærkelsesværdigt (MINERAL COVELLITE, 2014).

I minedriftsbranchen betegnes bornite- eller chalcopyritmineraler, der består af blandede kobber- og jernsulfider, ofte som "kobbersulfider".
I kemi er et "binært kobbersulfid" en hvilken som helst binær kemisk forbindelse af elementerne kobber og svovl. Uanset dens kilde varierer kobbersulfiderne bredt i sammensætningen med 0,5 ≤ Cu / S ≤ 2, herunder talrige ikke-støkiometriske forbindelser.
indeks
- 1 Fysiske og kemiske egenskaber af kobbersulfider
- 2 Reaktivitet og farer
- 3 anvendelser
- 4 referencer
Fysiske og kemiske egenskaber af kobbersulfider
Kobbersulfidet (I) og (II) har lignende udseende, idet de er både krystaller mørke, grå eller sorte.

Disse forbindelser kan differentieres ved deres krystallinske struktur. Kobbersulfid (I) har en monoklinisk struktur, medens kobber (II) sulfid har en hexagonal struktur (National Center for Biotechnology Information, S.F.).
De har en molekylvægt på henholdsvis 159,16 g / mol og 95,611 g / mol og en densitet på 5,6 g / ml og 4,76 g / ml for henholdsvis kobbersulfid (I) og (II) Bioteknologi Information, SF).
Kobbersulfid (I) har et smeltepunkt på 1100 ° C og er uopløseligt i vand og eddikesyre, der er delvist opløseligt i ammoniumhydroxid (Royal Society of Chemistry, 2015).
Kobbersulfid (II) har et smeltepunkt på 220 ° C, hvor den nedbrydes, er uopløselig i vand, saltsyre og svovlsyre og er opløselig i salpetersyre, ammoniumhydroxid og kaliumcyanid (Royal Society of Chemistry 2015 ).
Hydrogenperoxid reagerer kraftigt med kobber (II) sulfid og eksploderer ved kontakt med en koncentreret opløsning af chlor- eller cadmium-, magnesium- eller zinkchlorater.
Reaktivitet og farer
Kobbersulfiderne (I) og (II) er ikke klassificeret som farlige, men de kan være toksiske, hvis de indtages på grund af produktionen af hydrogensulfid. Symptomerne omfatter opkastning, mavesmerter og svimmelhed, kan virke irriterende på hud og øjne og indånding kan forårsage irritation i luftvejene (Sikkerhedsdatablad kobbersulfid, 1995).
Ved udsættelse for varme kan det frigive giftige dampe af svovl eller kobberoxid, der kan være sundhedsfarligt.
I tilfælde af kontakt med øjnene skal de straks skylles med en tilstrækkelig mængde vand i 15 minutter og løfte det nedre og øvre øjenlåg nogle gange.
Ved hudkontakt skylles straks med en tilstrækkelig mængde vand i 15 minutter, mens der fjernes forurenet tøj..
Ved indtagelse skal et giftkontrolcenter straks indkaldes. Skyl munden med koldt vand og giv offeret 1-2 kopper vand eller mælk til at drikke. Opkastning skal fremkaldes straks.
Ved indånding skal ofret tages på et køligt sted. Hvis du ikke trækker vejret, giv kunstigt åndedræt (Kobber (II) Sulfid, 2009).
applikationer
Kobbersulfid (I) anvendes som halvleder og i fotografiske applikationer (americanelements, 1998-2017). Dens anvendelser omfatter også brugen i solceller, lysemner, elektroder og visse sorter af faste smøremidler (Britannica, 2013).
Desuden kobbersulfid (II) finder anvendelser i solceller, superionic ledere, fotodetektorer, elektrisk ledende elektroder, anordninger fototermisk omdannelse beskyttende belægning mikrobølgeabsorberende aktiv radiobølge, gassensorer og polarisatorer stråling infrarød (azom, 2013).
Også kobber (II) sulfid (covelit) anvendes i undersøgelsen af nanopartikler:
- Med forskellige fremstillingsprocedurer (solvotermiske ruter, aerosolmetoder, opløsningsmetoder og termolyse)
- Og applikationer (fotokatalytisk nedbrydning, ablation af cancerceller, elektrodemateriale i lithium ion batterier og gassensor, felt emissionsegenskaber, applikationer super kondensatorer, fotoelektrokemiske ydeevne QDSCs, fotokatalytisk reduktion af organiske forureninger, bio- elektrokemisk detektion, forbedrede PEC karakteristika af forkogte CuS filmelektroder) (Umair Shamraiz, 2016).
I arbejde Geng Ku (2012) anvendelse af nanopartikler af kobbersulfid halvleder (CUS NP'er) til visning Photoacoustic tomografi med en Nd påvist: YAG ved en bølgelængde på 1064 nm.
Den CuS NP tillod visualisering af musehjerne efter intrakranial injektion, lymfeknuder rotte til 12 mm under huden efter interstitiel injektion og agarosegel indeholdende CuS NP indlejret i muskel kyllingebryst på en dybde på ~ 5 cm. Denne billedfremgangsmåde har stort potentiale for at opnå et molekylært billede af brystkræft.
referencer
- (1998-2017). Kobber (I) Sulfid. Hentet fra americanelements.com.
- (2013, april 19). Halvledere af kobbersulfid (CuS). Hentet fra azom.com.
- Britannica, T. E. (2013, 23. august). Kobber (Cu). Hentet fra britannica.com.
- Kobber (II) Sulfid. (2009, 23. januar). Hentet fra onboces.org.
- Geng Ku, M. Z. (2012). Copper Sulfide Nanoparticles Som en ny klasse af Photoacoustic Contrast Agent til Deep Tissue Imaging ved 1064 nm. ACS Nano 6 (8), 7489-7496.
- SIKKERHEDSDATABLAD Kobbersulfid. (1995, november). Hentet fra onboces.org.
- National Center for Bioteknologi Information. (S.F.). PubChem Compound Database; CID = 14831. Hentet fra pubchem.ncbi.nlm.nih.gov.
- National Center for Bioteknologi Information. (S.F.). PubChem Compound Database; CID = 62755. Hentet fra pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Kobber (II) sulfid. Hentet fra chemspider.com.
- Royal Society of Chemistry. (2015). Dikopper (1+) sulfid. Hentet fra chemspider.com.
- MINERALKALKOCITET. (2014). Hentet fra galleries.com.
- MINERAL COVELLITE. (2014). Hentet fra galleries.com.
- Umair Shamraiz, R. A. (2016). Fremstilling og anvendelse af kobbersulfid (CuS) nanostrukturer. Journal of Solid State Chemistry Volumen 238, 25-40.


