Theory of Bands Model og Eksempler
den band teori er en der definerer den elektroniske struktur af det faste som helhed. Det kan anvendes til enhver form for faststof, men det er i metallerne, hvor de største succeser afspejles. Ifølge denne teori stammer metallisk binding fra den elektrostatiske attraktion mellem de positivt ladede ioner og de mobile elektroner i krystallet.
Derfor har den metalliske krystal et "hav af elektroner", der kan forklare dets fysiske egenskaber. Det nederste billede illustrerer metalforbindelsen. De lilla prikker af elektronerne er delokaliseret i et hav, der omslutter de positivt ladede metalatomer.

"Elektronernes hav" er dannet ud fra de individuelle bidrag fra hvert metalatom. Disse bidrag er dets atomorbitaler. Metalkonstruktionerne er generelt kompakte; Jo mere kompakt de er, desto større er interaktionerne mellem deres atomer.
Som et resultat overlapper deres atomorbitaler til dannelse af meget snævre molekylære orbitaler i energi. Havet af elektroner er så kun et stort sæt molekylære orbitaler med forskellige energikategorier. Omfanget af disse energier udgør det såkaldte energibånd.
Disse bånd er til stede i en hvilken som helst region i krystallen, hvorfor det betragtes som en helhed, og derfra kommer definitionen af denne teori.
indeks
- 1 Model af energibånd
- 1.1 Fermi niveau
- 2 halvledere
- 2.1 Intrinsic og extrinsic halvledere
- 3 Eksempler på anvendt bandteori
- 4 referencer
Energibåndsmodel

Når orbitalet af et metalatom interagerer med dets nabo (N = 2), dannes to molekylære orbitaler: en af binding (grøn bånd) og et af anti-link (mørkt rødt bånd).
Hvis N = 3, dannes nu tre molekylære orbitaler, hvoraf den midterste (sorte bånd) ikke er bindende. Hvis N = 4 dannes fire orbitaler, og den med den største bindende karakter og den med den største anti-frysende karakter adskilles yderligere.
Sortimentet af energi til rådighed for molekylære orbitaler ekspanderer, da krystallens metalatomer tilvejebringer deres orbitaler. Dette resulterer også i et fald i energirummet mellem orbitalerne, til det punkt, de kondenserer i et bånd.
Dette band bestående af orbitaler har regioner med lav energi (de af grønne og gule farver) og høj energi (dem af orange og røde farver). Deres energiske ekstremer har lav densitet; Imidlertid er de fleste molekylære orbitaler (hvide striber) koncentreret i midten.
Det betyder, at elektroner "løber hurtigere" gennem midten af båndet end i deres ender.
Fermi niveau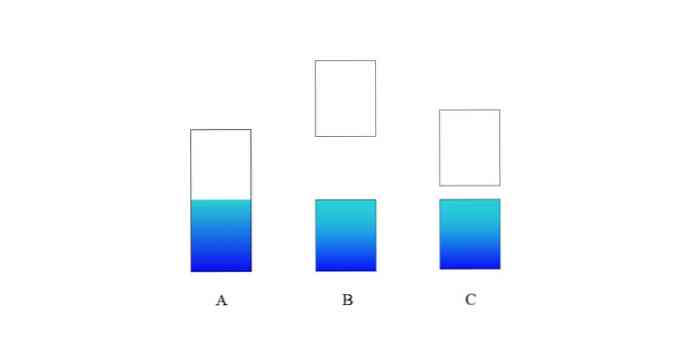
Det er den højeste energitilstand optaget af elektroner i et faststof ved den absolutte nul-temperatur (T = 0 K).
Når bandet er bygget, begynder elektronerne at besætte alle deres molekylære orbitaler. Hvis metallet har en enkelt valenselektron (er)1), vil alle elektronerne i sin krystal besætte halvdelen af bandet.
Den anden ubesatte halvdel er kendt som kørebåndet, mens bandet fyldt med elektroner hedder valensbåndet.
I det øverste billede repræsenterer A et typisk valensbånd (blåt) og ledningsbånd (hvidt) til et metal. Den blålige grænselinje angiver niveauet af Fermi.
Fordi metaller også har p-orbitaler, kombinerer de på samme måde som et p-band (hvidt).
I tilfælde af metaller er s og p-båndene meget tætte i energi. Dette tillader deres overlapninger og fremmer elektroner fra valensbåndet til ledningsbåndet. Dette sker selv ved temperaturer lidt over 0 K.
For overgangsmetallerne og fra periode 4 nedad er det også muligt at danne bånd af.
Fermi-niveauet med hensyn til ledningsbåndet er meget vigtigt for at bestemme de elektriske egenskaber.
For eksempel har et metal Z med en Fermi-niveau meget tæt på ledningsbåndet (det nærmeste tomme bånd i energi) en højere elektrisk ledningsevne end et X-metal, hvor dets Fermi-niveau er langt fra det pågældende bånd..
Halvledere
Den elektriske ledningsevne består derefter af migrering af elektroner fra et valensbånd til et ledningsbånd.
Hvis energikabellen mellem begge bånd er meget stor, har vi et isolerende faststof (som med B). På den anden side, hvis dette mellemrum er forholdsvis lille, er faststoffet en halvleder (i tilfælde af C).
På baggrund af en stigning i temperaturen får elektronerne i valensbåndet nok energi til at migrere mod ledningsbåndet. Dette resulterer i en elektrisk strøm.
Faktisk er dette en kvalitet af faste stoffer eller halvledermaterialer: ved stuetemperatur er de isolatorer, men ved høje temperaturer er de ledere.
Intrinsic og extrinsic halvledere

Intrinsiske ledere er dem, hvor energikløften mellem valensbåndet og ledningsbåndet er lille nok, så at den termiske energi tillader passage af elektroner.
På den anden side udviser extrinsiske ledere ændringer i deres elektroniske strukturer efter doping med urenheder, hvilket øger deres elektriske ledningsevne. Denne urenhed kan være et andet metal eller et ikke-metallisk element.
Hvis urenheden har flere valenselektroner, kan den tilvejebringe et donorbånd, der tjener som en bro for valensbåndets elektroner til at krydse ind i ledningsbåndet. Disse faste stoffer er halvledere af n-type. Her kommer n betegnelsen fra "negativ".
I det øvre billede er donorbåndet illustreret i den blå blok lige under drivbåndet (Type n).
På den anden side, hvis urenheden har mindre valenselektroner, tilvejebringer den et acceptorbånd, som forkorter energiforbruget mellem valensbåndet og drivbåndet..
Elektronerne migrerer først mod dette bånd og efterlader "positive huller", der bevæger sig i modsat retning.
Da disse positive huller markerer passage af elektroner, er faststoffet eller materialet en halvleder af p-type..
Eksempler på anvendt bandteori
- Forklar, hvorfor metaller er lyse: deres mobile elektroner kan absorbere stråling i en bred vifte af bølgelængder, når de hopper til højere energiniveauer. Så udsender de lys, der vender tilbage til lavere niveauer af kørebåndet.
- Krystallinsk silicium er det vigtigste halvledermateriale. Hvis en del silicium er doteret med spor af et gruppe 13 element (B, Al, Ga, In, Tl), bliver det en halvleder af p-type. Mens det dopes med et element i gruppe 15 (N, P, As, Sb, Bi) bliver det en halvleder af n-type.
- Lysdioden (LED) er en fælles halvleder p-n. Hvad mener du? At materialet har begge typer halvledere, både n og p. Elektronerne migrere fra ledningsbåndet af n-type halvleder, til valensbåndet af halvlederen p-type.
referencer
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Learning, s. 486-490.
- Shiver & Atkins. (2008). Uorganisk kemi (Fjerde udgave., S. 103-107, 633-635). Mc Graw Hill.
- Skib C. R. (2016). Band Theory of Solids. Hentet den 28. april 2018, fra: hyperphysics.phy-astr.gsu.edu
- Steve Kornic (2011). Går fra obligationer til bånd fra apotekets synspunkt. Hentet den 28. april 2018, fra: chembio.uoguelph.ca
- Wikipedia. (2018). Ekstrinsisk halvleder. Hentet den 28. april 2018, fra: en.wikipedia.org
- Byju'S. (2018). Band teori om metaller. Hentet den 28. april 2018, fra: byjus.com



